Profilaxis antibiótica durante el parto frente a infección por egb
Revisión de prensa
Por el Pr. Ener Cagri DINLEYICI
Servicio de Pediatría, Facultad de Medicina, Universidad Eskisehir Osmangazi, Eskisehir, Turquía
Otros factores de riesgo importantes para la composición de la microbiota intestinal de lactantes
La composición de la microbiota durante la primera infancia tiene una gran influencia sobre la programación inmunológica y metabólica, que puede predisponer a los niños a desarrollar una enfermedad más tarde en la vida.
Los primeros 1000 días son un período crítico para la vida entera, y los acontecimientos en las primeras etapas de la infancia (tipo de parto, nacimiento prematuro, prácticas alimentarias y consumo de antibióticos) pueden afectar la microbiota intestinal y nasofaríngea. Estudios recientes y algunos futuros planificados tienen como objetivo evaluar otros posibles factores de riesgo durante el embarazo, y después del período de primera infancia. Los antibióticos durante el parto se utilizan ampliamente en todo el mundo para la prevención de infecciones maternas asociadas al nacimiento por cesárea, y a la prevención y el manejo de infecciones por el estreptococo del grupo B (EGB).
El reciente estudio de Stearns et al., que fue publicado en Scientific Reports (2017) [1] con el título «Intrapartum antibiotics for GBS prophylaxis alter colonization patterns in the early infant gut microbiome of low risk infants» (Los antibióticos durante el parto para la profilaxis antibiótica del EGB alteran los patrones de colonización del microbioma intestinal de lactantes de bajo riesgo), es un ejemplo importante de los efectos de los antibióticos en la composición de la microbiota intestinal de lactantes sanos, nacidos a término y amamantados. En este estudio la composición de la microbiota de 53 lactantes nacidos por parto vaginal sin exposición a antibióticos con la de 14 lactantes que fueron expuestos a una profilaxis antibiótica durante el parto contra el Streptococcus del grupo B, y con la de otros 7 lactantes nacidos por cesárea, en Canadá.
En general, la microbiota intestinal de los lactantes nacidos por parto vaginal sin exposición a la profilaxis antibiótica durante el parto difería significativamente de la de los lactantes nacidos por parto vaginal, pero expuestos a la profilaxis antibiótica durante el parto frente al EGB, o de los lactantes nacidos por cesárea (también expuestos a profilaxis antibiótica intraparto). Con respecto a los resultados de este estudio, la microbiota fecal de los lactantes expuestos a la profilaxis antibiótica durante el parto tuvo una diversidad alfa significativamente menor, y, por lo contrario, la profilaxis antibiótica durante el parto frente a la exposición al EGB durante el parto vaginal puede afectar los niveles o la predominancia (retraso en la expansión) de Bifidobacterium más allá de las 12 semanas de vida.
Este estudio también demostró que la colonización de la microbiota intestinal del variar la distribución de las bacterias, al igual que la mayoría de los estudios publicados acerca del efecto del tipo de parto sobre la composición de la microbiota intestinal del lactante. Con este estudio se descubrió que la profilaxis antibiótica durante el parto frente al EGB afectaba todos los aspectos de la ecología microbiana intestinal, que incluye la abundancia de especies, su diversidad, su estructura comunitaria y la abundancia de géneros bacterianos colonizantes. Este estudio también demostró que la profilaxis antibiótica, para cualquier propósito, puede afectar la composición de la microbiota intestinal del lactante, y destacó la importancia del uso adecuado de los antibióticos.
En 2016, Cassidy-Bushrow y colegas publicaron las interacciones entre el estreptococo del grupo B materno y la microbiota intestinal de lactantes [2]. En este estudio, como parte de una cohorte poblacional de riesgo de nacimiento general, se tomaron muestras de heces de los pañales de lactantes en el primer y sexto mes de vida. Los autores demostraron que el estado del EGB materno estaba asociado significativamente a la composición bacteriana intestinal en el sexto mes, y que los lactantes de madres con EGB positivo presentaban estadísticamente mayor abundancia de Clostridiaceae, Ruminococcoceae y Enterococcaceae en el sexto mes. Estudios previos no pudieron observar los efectos a largo plazo en la composición de la microbiota intestinal. Mazzola et al. también demostraron las consecuencias a corto plazo de la profilaxis antibiótica materna durante el parto para prevenir la infección por EGB en la población microbiana de las heces de los lactantes, en particular de los lactantes amamantados [3].
La composición de la microbiota alterada se ha relacionado con la obesidad, alergias, enfermedad inflamatoria intestinal y cáncer de colon. Se necesitan estudios adicionales para definir efectos causales (si estos existen). Estos resultados también destacaron la necesidad médica insatisfecha de una posible inmunización materna con eventuales vacunas contra el EGB.
Foco sobre la semana asia pacífico de enfermedades digestivas
De vuelta del congreso
Por el Pr. Uday C Ghoshal
Departamento de Gastroenterología, SGPGI, Lucknow, India

La comprensión del sistema gastrointestinal (GI) y de sus trastornos ha mejorado recientemente gracias a los conocimientos sobre la microbiota intestinal (MI) y la disbiosis [1]. Durante este congreso se presentaron varios aspectos de la MI, que mencionamos en este artículo.
Introducción a la microbiota intestinal
Considerada como un auténtico órgano, la microbiota intestinal posee 10 veces más células (1014) que las células humanas de nuestro organismo (1013) [2]. Las funciones de la MI incluyen la digestión de los alimentos, el metabolismo de medicamentos y toxinas, la síntesis de vitaminas, un efecto barrera frente a las bacterias patógenas, una modulación de las funciones del sistema nervioso central, endocrino e inmunológico [2]. Si consideramos las diversas funciones de la MI, podemos asumir que su alteración está relacionada con varias enfermedades, y que su modulación puede ser beneficiosa.
La función de la microbiota intestinal en el cáncer colorrectal
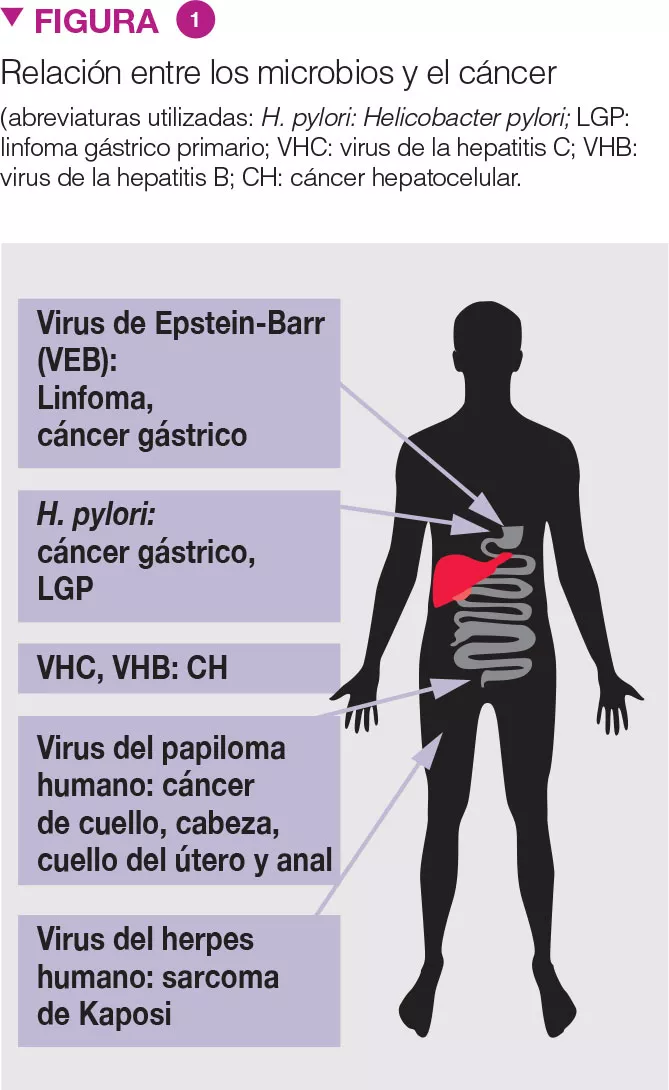
La asociación entre microorganismos y cáncer es conocida (Fig. 1) [3]. Recientemente, nuevos datos sugieren el rol de la disbiosis en el CCR. La microbiota fecal de pacientes con pólipos de colon se parece a la de pacientes con CCR. Mientras que Clostridium spp., Bacteroides spp. y Bifidobacterium spp. están asociados al CCR, las bacterias productoras de ácido láctico (p. ej., Lactobacillus spp. y Eubacterium aerofaciens) están negativamente asociadas con el CCR. La producción de metano y de H2S (sulfuro de hidrógeno) asociada a la MI, y la presencia de Streptococcus bovis, podrían desempeñar una función en el desarrollo del CCR. Además, se ha sugerido que la obesidad podría estar relacionada con la MI, y esta constituir un factor predisponente de CCR.
La microbiota intestinal y la obesidad
La extracción de calorías de los alimentos no solo depende de la función digestiva del intestino delgado, sino también de la extracción de calorías malabsorbidas por la microbiota del colon. Mientras que la presencia de Firmicutes está asociada con una mayor extracción de calorías, las Bacteroidetes tienen el efecto contrario [4].
Se ha evidenciado una microbiota fecal diferente entre personas obesas y personas no obesas. En un estudio retrospectivo de cohortes en el Reino Unido, de 21 714 lactantes, 1306 (6 %) eran obesos a la edad de 4 años. En un análisis de regresión logística y tomando en cuenta el contexto familiar, la exposición a antibióticos antes de los 2 años de edad se asoció al desarrollo de la obesidad, y el número de ciclos de antibióticos se correlacionaba con el desarrollo de la obesidad [5].
Otros síndromes metabólicos
La esteatosis hepática no alcohólica (EHNA) y el síndrome metabólico pueden estar asociados a una disbiosis, incluyendo un aumento cuantitativo de las bacterias del intestino superior [6]. Un estudio no controlado y tres estudios de casos y controles demostraron que el crecimiento excesivo bacteriano en el intestino delgado estaba asociado con la EHNA [6]. Dos estudios demostraron una abundancia relativa menor de Bacteriodetes, y una abundancia mayor de C. coccoides y de Prevotella, en pacientes con EHNA. Una mayor extracción de calorías de carbohidratos complejos no absorbidos, una resistencia a la insulina, y una producción endógena de alcohol puede contribuir a la patogenia de la EHNA debido a la disbiosis.
La MI desempeña un papel importante en el metabolismo de la glucosa, la resistencia a la insulina, la diabetes, y tiene una incidencia en su tratamiento. Los pacientes con diabetes tienen microbiotas fecales distintas de las de la población control [4]. Se demostró que la MI es un factor importante de regulación de los niveles de glucosa después de la ingesta de diferentes alimentos, independientemente del ejercicio físico y/o del estilo de vida [7]. Es posible que la metformina, un antiglicémico oral, funcione parcialmente mediante la alteración de la MI. A pesar de que los estudios sobre la función de la MI en la enfermedad coronaria son escasos y poseen resultados diversos, están surgiendo nuevos datos que sugieren su implicación en esta enfermedad.
Uso indebido de antibióticos en asia
El uso de antibióticos en Asia es elevado, y la implementación de políticas para el uso debido deja que desear, lo que implica un riesgo de aparición de superbacterias resistentes a los antibióticos. Este uso indebido se explica por una disponibilidad sin restricciones, y un uso en indicaciones inadecuadas como, por ejemplo, resfriados o gastroenteritis aguda. El uso de probióticos, cuando corresponde, puede ayudar a contener el uso indebido de antibióticos.
Manipulación de la microbiota intestinal con agentes diferentes de los antibióticos
Aunque la modulación de la MI por parte de la rifaximina ya se conoce, los probióticos y el trasplante fecal son potencialmente interesantes para tratar los trastornos asociados a la disbiosis. Los probióticos pueden ser prescritos de forma concomitante en caso de tratamiento de eliminación de Helicobacter pylori. Hay metaanálisis que muestran que la administración concomitante de probióticos puede restaurar la eubiosis, y aumenta la tasa de erradicación, debido a menores efectos adversos y a un mejor cumplimiento [9]
A partir de 23 ensayos controlados aleatorizados, el Colegio Estadounidense de Gastroenterología recomendó la utilización de probióticos para mejorar el meteorismo y la flatulencia en el síndrome del intestino irritable[8]. Un análisis de Cochrane demostró la utilidad de los probióticos en la prevención de la diarrea asociada a Clostridium difficile [9]. Un metaanálisis demostró que los probióticos de diferentes especies provocan y mantienen la remisión de la rectocolitis hemorrágica, aunque los datos de la enfermedad de Crohn son limitados [10].
Orientaciones futuras
Con el objetivo de formar un consorcio de la región Asia Pacífico sobre la MI, similar a los grupos europeos y norteamericanos, y de analizar los datos actuales en la región Asia Pacífico, se ha desarrollado y publicado un consenso [9]. Las principales conclusiones del consenso son las siguientes: aumenta la evidencia que respalda el potencial terapéutico de los probióticos para modular las funciones gastrointestinales, y aliviar los síntomas de estos trastornos, pero se necesita más investigación [9].
Informe sobre el 30a congreso del grupo europeo de helicobacter
De vuelta del congreso
Por el Pr. Francis Mégraud
Laboratorio de Bacteriología Hospital Universitario Pellegrin, Burdeos, Francia

Del 7 al 9 de septiembre de 2017 se realizó el 30° congreso del European Helicobacter & Microbiota Study Group en Burdeos, Francia, donde ya tuvo lugar el primer encuentro de este grupo en 1988. Un importante avance fue la incorporación, como tema, de la microbiota intestinal, que incluyó un curso de posgrado sobre “Antibioticoterapia y el intestino: nuevos conceptos”, una clase magistral sobre la microbiota y varios simposios y talleres sobre el tema.
La aportación determinante de la culturómica
D. Raoult de Marsella, Francia, realizó la primera presentación del curso de posgrado, durante la cual se repasaron los conceptos de la microbiota intestinal mediante culturomics. De hecho, los estudios con secuenciación de ADNr 16S y la metagenómica han abierto este campo, pero tienen limitaciones, tales como discrepancias que ocurren a nivel de la extracción de ADN, de la secuenciación y del análisis bioinformático, y por falta de minorías de población. Por estos motivos, surgió el concepto de culturomics, que permite el descubrimiento de un número importante de nuevas especies bacterianas, Archaea, y también grandes virus, que no pudieron detectarse por análisis metagenómicos. Este enfoque, que al comienzo era extremadamente engorroso (200 medios diferentes utilizados), ahora es más práctico en su laboratorio, donde se utilizan únicamente 17 medios en simultáneo, lo que permite detectar discrepancias todas las semanas.
Microbiota y antibióticos
La segunda charla también fue fascinante. M. Blaser (Nueva York, NY, EE. UU.) presentó la supuesta conexión entre la microbiota intestinal y varias enfermedades crónicas cuyas etiologías siguen siendo dudosas, como el asma, la obesidad, la diabetes y la enfermedad inflamatoria intestinal, entre otras. La prevalencia de estas enfermedades aumenta en todo el mundo, y en paralelo al aumento del uso de los antibióticos. Actualmente existen datos que demuestran que las bacterias que han coevolucionado con el humano son esenciales para una buena salud. La microbiota se establece en una franja de edad (entre los 0 y los 3 años) y es posible que el consumo de antibióticos a esta edad resulte en la desaparición de parte de la microbiota y, por lo tanto, de la diversidad bacteriana, que es un importante criterio para la salud. Los experimentos en ratones han demostrado que los antibióticos pueden modificar la composición de la microbiota intestinal, que tienen un impacto en el aumento de la adiposidad y la modificación de la respuesta inmunológica, así como que favorecen el desarrollo de varias enfermedades.
Después de describir el estado actual de la disbiosis intestinal asociada con varias enfermedades, un enfoque interesante fue considerar cómo limitar el efecto de los antibióticos en la microbiota intestinal. Una primera aproximación sería agregar probióticos a los tratamientos con antibióticos, pero los probióticos no son todos iguales. Saccharomyces boulardii parece destacar en esta área. Todos los estudios demuestran el efecto beneficioso de esta levadura sobre la diarrea asociada a los antibióticos. Entre los lactobacilos, hay una especie emergente interesante para este fin: Lactobacillus rhamnosus GG, como explicó H. Sokol.
Nuevas aproximaciones
Actualmente existen enfoques sin probióticos que previenen la disbiosis intestinal. Estos fueron presentados por A. Andremont. De hecho, los antibióticos se absorben en el intestino delgado, y sus efectos negativos en la microbiota intestinal ocurren esencialmente en el colon. Ya se ha intentado administrar betalactamasa en el colon para evitar los efectos de los antibióticos betalactámicos, así como otras alternativas que utilizan carbón activado de tipo absorbente recubierto. Los experimentos en ratones y perros han sido exitosos, en especial para los antibióticos del grupo de las fluoroquinolonas.
Una vez que se establece la disbiosis, es posible la restauración mediante un trasplante de microbiota fecal (TMF). Un TMF alogénico puede curar la infección por Clostridium difficile. El autotrasplante puede ser una opción en caso de un tratamiento con antibióticos planificado, y sería más aceptable debido a que se evitaría un riesgo por patógenos desconocidos. El TMF necesita una legislación común en Europa y una estandarización de su proceso.
El contenido de heces de lactantes con cólicos induce hipersensibilidad visceral en ratones
Artículo comentado - niño
Por el Pr. Emmanuel Mas
Gastroenterología y nutrición, Hospital de Niños, Toulouse, Francia

El comentario del artículo original de Eutamène et al. (Neurogastroenterol Motil 2017)
Poco se comprende de la fisiopatología de los cólicos infantiles, a pesar de que diversos estudios informan sobre la disbiosis intestinal en lactantes con cólicos. Nuestro objetivo fue evaluar la hipótesis de que la disbiosis asociada a los cólicos está relacionada con una hipersensibilidad visceral desencadenada por una alteración del contenido intraluminal.
Se estudiaron muestras fecales de siete lactantes con cólicos y de otros siete sin cólicos. Se infundieron sobrenadantes fecales (SF) en cólones de ratones C57/Bl6 (n=10/muestra). Posteriormente se evaluó la sensibilidad visceral en los animales mediante el registro de la respuesta muscular abdominal a la distensión colorrectal (DCR) a través de una electromiografía (EMG). Se evaluó la actividad de las proteasas de cisteína y serina en los SF con sustratos específicos. Se analizó la composición de la microbiota fecal de lactantes mediante la extracción de ADN y de la pirosecuenciación del gen 16S rARN.
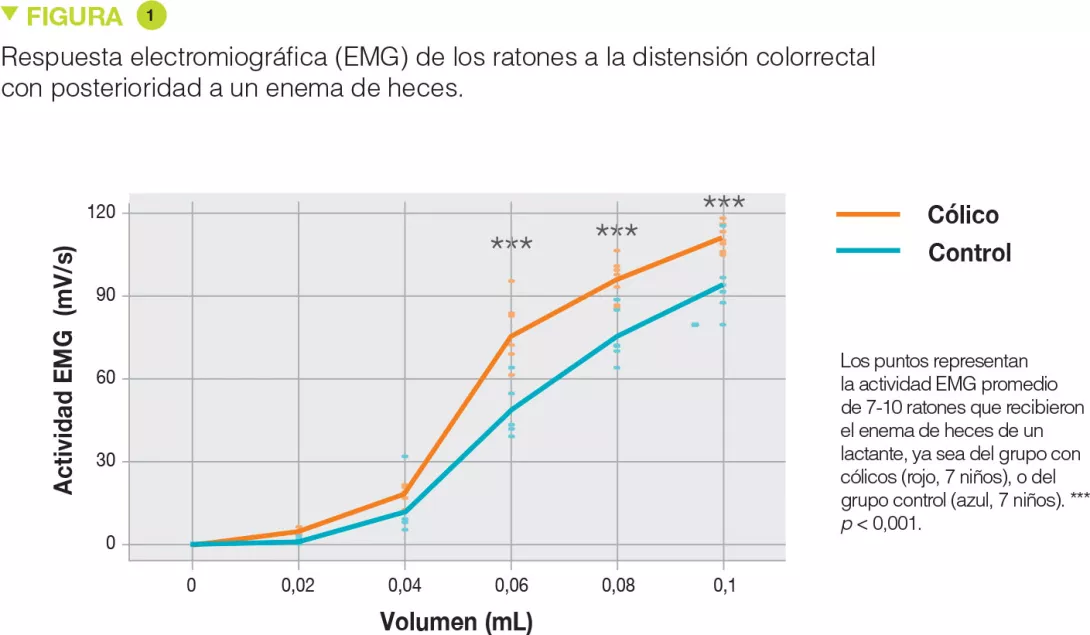
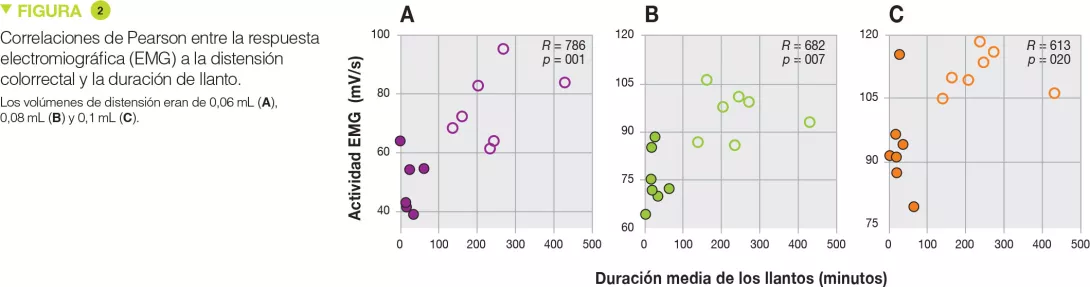
Los SF de los lactantes con cólicos desencadenaron una actividad mayor en la EMG que los SF de los lactantes sin cólicos, en respuesta a los mayores volúmenes de DCR y en general, ya que se evaluó el área bajo la curva de la EMG en todos los volúmenes de la DCR. El tiempo de llanto de los lactantes está fuertemente relacionado con la actividad de la EMG de los ratones. La variedad de microbiota y la diversidad filogénica aumentaron en el grupo con cólicos, sin mostrar alteraciones destacadas en la composición microbiana. En el grupo con cólicos solo aumentaron Bacteroides vulgatus y Bilophila wadsworthia. La abundancia de Bacteroides vulgatus está positivamente relacionada con la sensibilidad visceral. No se encontraron diferencias en las actividades de la proteasa.[1]
¿Qué es lo que ya se sabe sobre este tema?
Los cólicos del lactante forman parte de las alteraciones funcionales gastrointestinales y se definen según los criterios de Roma. Su fisiopatología todavía es poco conocida, si bien se sospecha de un mecanismo intestinal doloroso. Hay estudios que sugieren que una perturbación de la microbiota intestinal, un aumento de la permeabilidad intestinal, y una inflamación intestinal de bajo grado, estarían implicados en la hipersensibilidad visceral. Esos factores intervienen en la fisiopatología del síndrome del intestino irritable. En este síndrome, una anomalía del balance entre proteasas y antiproteasas tiene un rol en la hipersensibilidad visceral y en la inflamación de bajo grado.
¿Cuáles son los principales resultados brindados por este estudio?
El objetivo de este estudio era investigar si una perturbación de la microbiota intestinal, asociada a un aumento de las proteasas intestinales, era capaz de inducir una hipersensibilidad visceral. En el estudio se incluyeron niños en lactancia materna de entre 1 y 4 meses de edad. No había diferencias en cuanto a la duración del embarazo, al peso en el nacimiento y a los antecedentes familiares de alergia, entre el grupo con cólicos (n = 7) y el grupo control (n = 7). Por definición (criterios de Roma III), solo la duración de llanto difería, en promedio de 240 ± 95,95 minutos (grupo con cólicos) frente a 24,04 ± 19,65 minutos (grupo control).
Los enemas rectales de heces de lactantes con cólicos provocaron una hipersensibilidad significativa durante la distensión rectal con volúmenes más importantes (+55 %, p < 0,001 a 0,06 mL; +27 %, p < 0,001 a 0,08 mL y +19 %, p < 0,001 a 0,1 mL) (Figure 1), pero también en respuesta global (aumento del área bajo la curva de +33 %, p < 0,001). Además, existía una correlación positiva con la duración de llanto para esos volúmenes de distensión (Figure 2). Por el contrario, no había diferencias en cuanto a las cantidades de proteasas (serina, y sustancias similares a la tripsina y la elastasa) entre ambos grupos.
Finalmente, el análisis de la microbiota mostró un aumento de la diversidad y una mayor abundancia de Bacteroides vulgatus y de Bilophila wadsworthia en los niños con cólicos de lactante. La abundancia relativa de B. vulgatus estaba asociada positivamente a la hipersensibilidad de los ratones (p = 0,021) y no significativamente a la duración de lo llanto (p = 0,067).
Puntos clave
-
Las heces de lactantes con cólicos desencadenan una hipersensibilidad visceral, como los que encontramos en el síndrome del intestino irritable.
-
Se necesitan estudios complementarios para determinar los compuestos implicados, su mecanismo de acción y su relación con una perturbación de la microbiota intestinal.
¿Cuáles son las consecuencias en la práctica?
Este estudio muestra que un componente contenido en las heces del lactante con cólicos es capaz de desencadenar una hipersensibilidad visceral en ratones. Podría tratarse de un aumento de un compuesto nociceptivo o de la disminución de un compuesto antinociceptivo. No se trata de una alteración del balance proteolítico, pero es posible que ese compuesto sea provocado por una microbiota intestinal diferente. Sin embargo, es necesario realizar estudios complementarios para identificar cuál podría ser ese compuesto, y cuál sería el mecanismo de acción.
Conclusión
La transferencia de heces de lactantes con cólicos vía enema a ratones es capaz de inducir una hipersensibilidad visceral. Esto causa un mecanismo abdominal doloroso y la implicación, directa o indirecta, de la microbiota intestinal en la fisiopatología de los cólicos del lactante. Este modelo podría utilizarse para determinar cuáles son las vías metabólicas modificadas por una perturbación de la microbiota intestinal e implicadas en los cólicos del lactante.
La mejora de la sensibilidad a la insulina posterior al trasplante de microbiota fecal depende de la composición inicial de la microbiota de los receptore
Artículo comentado - adulto
Por el Pr. Harry Sokol
Servicio de gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
El comentario del artículo original de Kootte et al. (Cell Metab 2017)
La microbiota intestinal tiene incidencia en la resistencia a la insulina, si bien las pruebas relativas a la relación de causalidad son limitadas. Hemos comparado el efecto de un trasplante de microbiota fecal (TMF) de un donante delgado (alogénico) con el de un autotrasplante (autólogo) en pacientes de sexo masculino con síndrome metabólico. Si bien no se observó ningún cambio metabólico 18 semanas después del TMF, la sensibilidad a la insulina había mejorado significativamente a las 6 semanas en el grupo TMF alogénico, y eso estaba asociado a una modificación de la composición de la microbiota. También hemos informado cambios en las concentraciones de metabolitos plasmáticos como el ácido γ-aminobutírico, y hemos mostrado que la respuesta metabólica posterior al TMF (definida como la mejora de la sensibilidad a la insulina 6 semanas después del TMF) se observa en pacientes con una diversidad microbiana reducida al estado basal. En conclusión, los efectos beneficiosos del TMF de donantes delgados en el metabolismo glucídico se asocian a cambios de la microbiota intestinal y de los metabolitos plasmáticos, y pueden predecirse a partir de la composición basal de la microbiota del receptor.[4]
¿Qué es lo que ya se sabe sobre este tema?
La obesidad y las patologías asociadas a ella, como la diabetes, requieren nuevos enfoques terapéuticos, porque los tratamientos actuales, las modificaciones en el estilo de vida y los tratamientos antidiabéticos no son suficientemente eficaces para reducir la morbilidad y la mortalidad. Durante la última década, los cambios en la composición de la microbiota intestinal han emergido como una nueva estrategia terapéutica potencial para mejorar la sensibilidad a la insulina [1]. Varios estudios han mostrado que la composición de la microbiota intestinal difiere entre animales delgados y obesos, pero también que la composición microbiana podría ser el reflejo de funciones metabólicas alteradas, en particular con una perturbación de los alimentos ingeridos [2]. Finalmente, estos estudios en animales han sugerido una relación causal entre las anomalías de la microbiota y el síndrome metabólico, dado que el fenotipo es transferible por TMF [2]. Si bien numerosos estudios observacionales han sugerido correlaciones entre una composición alterada de la microbiota y el metabolismo humano, ha sido difícil probar la causalidad. Los autores del presente estudio han demostrado previamente, en un pequeño estudio piloto, que el TMF de donante delgado a hombres con síndrome metabólico inducía una mejora del metabolismo glucídico, de forma paralela a cambios en la microbiota fecal y duodenal [3]. Esos resultados animaron a los autores a estudiar los efectos a corto y largo plazo del TMF de donante delgado en la composición de la microbiota intestinal en un grupo más grande de hombres con síndrome metabólico, y a explorar la fisiopatología de la resistencia a la insulina, correlacionando los cambios de la microbiota intestinal con varios marcadores del metabolismo. Además, los autores han intentado identificar las características basales de la microbiota de los receptores que permitan explicar la mejora de la sensibilidad a la insulina en determinados pacientes (identificados como respondedores metabólicos) pero no así en otros (no respondedores).
Puntos clave
-
El TMF de donante delgado mejora la sensibilidad a la insulina de pacientes obesos con síndrome metabólico
-
Existe una variabilidad interindividual en la respuesta y esta última es transitoria
-
La mejora de la sensibilidad a la insulina está relacionada con cambios en los metabolitos plasmáticos
-
La respuesta al TMF depende de la composición inicial de la microbiota de los pacientes
¿Cuáles son los principales resultados brindados por este estudio?
Treinta y ocho hombres obesos con síndrome metabólico fueron incluidos y aleatorizados en el grupo TMF alogénico (n = 26) o en el grupo autólogo (n = 12). El TMF se realizó por sonda nasoduodenal y se repitió 6 semanas después. Dieciocho semanas después del TMF, no se observaba ningún efecto, ni en la microbiota, ni en los parámetros del síndrome metabólico. Ahora bien, 6 semanas después del TMF, la microbiota del grupo TMF alogénico se había modificado, y los parámetros metabólicos, en especial la sensibilidad a la insulina, habían mejorado, mientras que no se observaba ningún cambio en el grupo TMF autólogo (Figure 1). Contrariamente a lo sucedido en su anterior estudio, no se observó ningún cambio en la concentración de butirato fecal [3]. Por el contrario, el TMF alogénico estaba asociado a un aumento de la concentración de acetato fecal, así como a modificaciones del porcentaje de una treintena de metabolitos sanguíneos, muchos de ellos implicados en el metabolismo del triptófano. En el subgrupo de pacientes que respondieron favorablemente al TMF alogénico, se observaron cambios en la microbiota fecal como, por ejemplo, un aumento de la bacteria Akkermansia muciniphila, cuyos efectos favorables sobre el síndrome metabólico se han demostrado en ratones. Los autores también pusieron en evidencia que la composición basal de la microbiota, así como su poca diversidad, permitían predecir una buena respuesta al TMF.
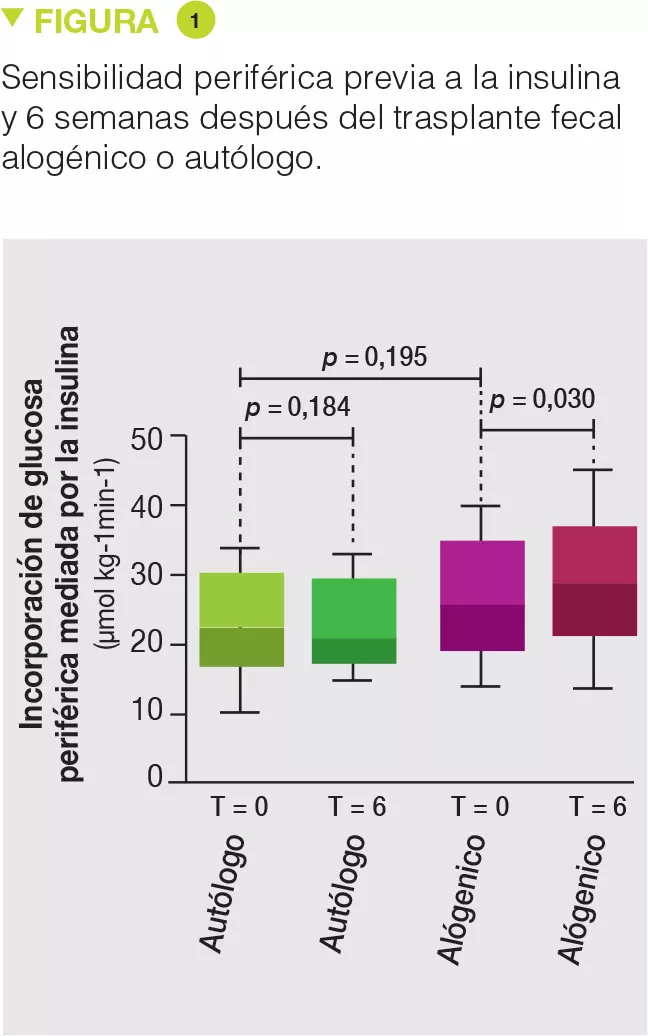
¿Cuáles son las consecuencias en la práctica?
Las intervenciones en la microbiota intestinal, y en particular el TMF, son una pista terapéutica válida en el síndrome metabólico. Sin embargo, existe una fuerte variabilidad interindividual en la respuesta, que puede vincularse tanto a factores del huésped como del donante. Por otra parte, los efectos son relativamente modestos con un único TMF y, en el mejor de los casos, son transitorios. Estrategias más focalizadas, como el uso de probióticos de nueva generación (bacterias provenientes de la microbiota), y con una administración prolongada, son más atractivas y se encuentran actualmente en estudio.
Conclusión
Este estudio de intervención demuestra que la microbiota intestinal no es un simple testigo pasivo sino un actor en el síndrome metabólico. Los mecanismos implicados podrían pasar por la producción de metabolitos por parte de la microbiota intestinal que modulen las vías de señalización del huésped. Sin embargo, los efectos son relativamente modestos y transitorios. Estrategias más focalizadas, como el uso de probióticos de nueva generación, y con una administración prolongada, son más atractivas y se encuentran actualmente en estudio.
Tratamiento con antibióticos en niños: consecuencias a corto y largo plazo sobre el microbioma
Síntesis
Por el Pr. Yvan Vandenplas
Por el Prof. Yvan Vandenplas Jefe del Departamento de Pediatría, KidZ Health Castle, Bruselas, Bélgica
La microbiota intestinal humana consiste en los microorganismos que viven en el intestino, y se ha calculado que equivale a la cantidad total de células humanas en el organismo [1]. La colonización microbiana del intestino humano comienza en el útero, ya que se han encontrado bacterias en el cordón umbilical, la placenta, el líquido amniótico y el meconio [2]. Después del nacimiento, una microbiota diversificadora coloniza rápidamente el tracto gastrointestinal, y es en los primeros años de vida que se constituye un microbioma intestinal estable. La colonización microbiana está determinada por muchos factores, por ejemplo la microbiota materna, el tipo de parto, la alimentación, y medicamentos como los antibióticos y los inhibidores de la bomba de protones [1]. Los antibióticos no solo matan a los patógenos bacterianos, sino que también alteran profundamente el equilibrio del microbioma gastrointestinal. El uso de antibióticos aumentó mundialmente en un 36 % en una década, y son una causa bien conocida de disbiosis [3]. Si bien las consecuencias a corto plazo de la disbiosis inducida por antibióticos son bien conocidas, están surgiendo datos recientes relacionados con las consecuencias a largo plazo. Estas consecuencias son el foco de este informe.
Diarrea asociada a antibióticos
La consecuencia más frecuente y mejor estudiada de la disbiosis intestinal debido a la toma de antibióticos es la diarrea asociada a antibióticos (DAA). La DAA ocurre en ±20 % de los ciclos de antibiótico, y depende del tipo de sustancia, el factor de riesgo de los pacientes (factores del huésped, estado de hospitalización, brotes nosocomiales) y de la definición de DAA. La DAA se define como un cambio en la frecuencia de las heces, con al menos 3 deposiciones líquidas por día durante 2 días consecutivos, que ocurren durante el tratamiento con antibióticos (aparición temprana), o de 2 a 6 semanas (aparición tardía), y si no se puede identificar otra causa (infección bacteriana o viral concomitante, uso de laxantes, otras causas). La clase de antibióticos (amplio espectro), la duración de la administración y la edad del paciente son factores de riesgo en el desarrollo de DAA. La administración de algunas cepas de probióticos como Lactobacillus rhamnosus y Saccharomyces boulardii reducen la incidencia y la gravedad de la DAA [4].
Antibióticos en edad temprana
Es posible que los antibióticos tengan un efecto mucho más amplio, en especial si se administran en la etapa perinatal o en niños pequeños. Durante el parto vaginal o en la cesárea, los antibióticos están relacionados con la disbiosis de la microbiota intestinal infantil [5]. La disbiosis adquirida durante la etapa perinatal o a edades tempranas tiene consecuencias a largo plazo. El tratamiento con antibióticos en la madre durante el embarazo y la lactancia provoca alteraciones profundas en la composición de la microbiota de las madres y de los lactantes [6]. Los antibióticos prenatales están asociados a un mayor índice de masa corporal (IMC) a la edad de dos años [7].
Antibióticos y peso
Desde la década de 1950, se han utilizado dosis subterapéuticas de antibióticos como promotores del crecimiento en la cría de animales [8]. El efecto es más pronunciado con antibióticos de amplio espectro y disminuye cuando los animales se crían en buenas condiciones sanitarias. La evidencia empírica en aumento sugiere que los antibióticos también afectan el crecimiento humano. En 1955, un estudio comparativo aleatorizado en reclutas de la Marina demostró que un ciclo de 7 semanas de antibióticos provocaba un aumento de peso significativamente mayor en el grupo tratado en comparación con el grupo con placebo [8].
Existe una relación lineal positiva entre el peso en el nacimiento y el IMC en niños de 6 a 7 años, presente en países de diferente nivel económico [9]. La microbiota intestinal de los lactantes predice el IMC futuro, y puede servir como indicador temprano de riesgo de obesidad. Las bifidobacterias y los estroptococos, que son indicadores de la maduración de la microbiota en niños pequeños, son posibles candidatos de la programación metabólica de los niños, y su influencia en el IMC parece depender del uso de antibióticos [10].
La exposición a antibióticos antes de los 6 meses de edad o de forma repetida durante el primer año de vida se ha relacionado con un aumento en la masa corporal en niños sanos [11]. La exposición repetida a antibióticos a temprana edad, en especial a agentes betalactámicos, está relacionada con un aumento de peso y de altura [12]. Es posible que estos efectos desempeñen un papel en la epidemia mundial de obesidad infantil y, además, subrayan la importancia del uso sensato de antibióticos durante el primer año de vida, lo que favorece el uso de antibióticos de espectro reducido [11]. Si se pudiera establecer la causalidad de la obesidad en estudios futuros, esto justificaría aún más la necesidad de un uso restrictivo de los antibióticos [12].
La administración de tres o más ciclos de antibióticos en niños menores de dos años de edad está asociada con un aumento en el riesgo de obesidad infantil temprana [13]. En un estudio de cohortes, el 6,4 % de los niños eran obesos a la edad de cuatro años [13]. En esta cohorte, la exposición a antibióticos se asociaba con un aumento en el riesgo de obesidad a los cuatro años: cuantos más ciclos de antibióticos, mayor era el riesgo [13]. Los niños que recibieron antibióticos en el primer año de vida eran más propensos a tener sobrepeso más adelante en su infancia, si se los compara con aquellos que no estuvieron expuestos (32,4 % vs. 18,2 % a la edad de 12 años, p = 0,002) [14]. La exposición repetida a antibióticos de amplio espectro en edades de 0 a 23 meses está asociada con la obesidad infantil temprana [15].
Sin embargo, algunos estudios aportaron resultados contradictorios. La exposición a antibióticos dentro de los primeros 6 meses de vida, en comparación con la no exposición, no estuvo asociada con una diferencia estadísticamente significativa con el aumento de peso hasta los 7 años de edad[16].
Microbioma intestinal: inmunidad y alergia alimentaria
Las interacciones simbióticas del huésped y los microbios son esenciales para el desarrollo metabólico y de inmunización del huésped. La colonización temprana de la microbiota puede influenciar el desarrollo de enfermedades inmunológicas y metabólicas [1].
Se encontró una relación clara entre el uso de antibióticos a temprana edad (3 o más ciclos de tratamiento) y la alergia a la leche, a otros alimentos y a otros tipos de alergias, en un análisis de datos longitudinal de 30 060 niños [17]. Estas relaciones eran más notables en niños más pequeños, y eran diferentes según el tipo de antibiótico [17].
El uso de antibióticos antes y durante el embarazo se asoció con un mayor riesgo de alergia a la leche de vaca en los hijos y persistió tras ajustar posibles factores de confusión [17]. El riesgo de alergia a la leche de vaca aumentó con una cantidad mayor de antibióticos administrados en niños, desde el nacimiento hasta el diagnóstico (test de tendencia p < 0,001) [18]. La profilaxis antibiótica durante el parto tuvo un efecto importante en la población microbiana fecal, particularmente en lactantes amamantados [19]. La administración de antibióticos durante el parto resulta en una reducción significativa de las cepas de Bifidobacterium spp. [20]. La menor abundancia de estos microorganismos beneficiosos, junto con el aumento en la cantidad de bacterias potencialmente patógenas, puede sugerir que estos niños estarán más expuestos a trastornos gastrointestinales o de salud general en el futuro [20].
Antibióticos y vías respiratorias
Los antibióticos administrados durante la primera semana de vida son un factor de riesgo para la rinitis alérgica y las sibilancias, mientras que la introducción temprana de alimentos sólidos, como el pescado, y vivir en una granja, son factores protectores del desarrollo posterior de alergias. Los antibióticos administrados durante el primer año de vida están relacionados con un riesgo aumentado de asma [21]. La solidez de la relación difiere según la clase de antibióticos, que se correlaciona con su efecto en el microbioma intestinal [21]
La exposición a antibióticos se relacionó con un aumento en el riesgo de padecer asma en las edades de 3 y 6 años [22], en presencia o ausencia de una infección en las vías respiratorias inferiores, durante el primer año de vida [22]. El efecto adverso de los antibióticos fue particularmente intenso en niños sin historial familiar de asma (P(interacción) = 0,03) [22]. La toma de antibióticos también fue un factor de riesgo para un resultado positivo en la prueba de alergia en sangre o piel. Según una revisión científica sistemática publicada en 2011, la exposición a antibióticos en el primer año de vida es un factor de riesgo importante para el desarrollo de asma. Los estudios retrospectivos obtuvieron la mayor estimación de riesgo combinado para el asma, en comparación con estudios prospectivos y de bases de datos. Las infecciones respiratorias, la aparición tardía de asma (a los 2 años o posterior) y la exposición a antibióticos durante el embarazo son factores de riesgo independientes.
El uso de antibióticos en el primer año de vida se relacionó con el desarrollo de sibilancias transitorias y de asma persistente [23]. Se observó un efecto entre dosis y respuesta: tras recibir 5 o más ciclos de antibiótico, el riesgo de desarrollar asma aumentó significativamente (p < 0,01). No existe relación entre el uso de antibióticos y el asma de aparición tardía [23]. El uso de antibióticos en el primer año de vida está relacionado con un aumento en el riesgo de desarrollar asma de inicio temprano, antes de los 3 años de edad. La causalidad inversa y un sesgo protopático pueden ser factores de confusión de esta relación [23].
Antibióticos y enfermedad inflamatoria intestinal
La exposición a antibióticos en la infancia está asociada con la enfermedad inflamatoria intestinal (EII), y esta relación disminuye al aumentar la edad de exposición a antibióticos. La exposición antes de 1 año de edad implica un mayor riesgo, que disminuye a los 5 y 15 años, aunque incluso a la edad de 15 años todavía representa un factor de riesgo importante para desarrollar EII [24]. Cada ciclo de antibióticos aumentó el riesgo de EII en un 6 % (4 %- 8 %) [24]. Como en cualquier estudio observacional, la causalidad no puede deducirse de esos días, y los factores de confusión por indicación (prescripción de antibióticos a niños con síntomas intestinales de EC todavía no diagnosticada) deben tenerse en cuenta [25]. El uso de antibióticos es común en la infancia, y su potencial como factor de riesgo medioambiental para la EII justifica su control [25]. La exposición a antibióticos tiene una fuerte relación con la enfermedad de Crohn, que se intensifica en niños, pero no es significativa para la colitis ulcerosa [26].
Antibióticos y diabetes
La exposición a una sola prescripción de antibióticos no se ha asociado con un riesgo mayor de diabetes [27], mientras que con dos a cinco ciclos de antibióticos existe una relación con el aumento de riesgo diabético para la penicilina, las cefalosporinas, los macrólidos y las quinolonas. El riesgo aumentó con la cantidad de ciclos de antibióticos. No hubo relación entre la exposición a antivirales y antifúngicos, y el riesgo de diabetes [27]. Es posible que la exposición a antibióticos aumente el riesgo de padecer diabetes tipo 2 [28]. Sin embargo, estos hallazgos también pueden indicar un aumento de la utilización de antibióticos debido al aumento del riesgo de infecciones en pacientes con diabetes todavía no diagnosticada [28]. La exposición a antibióticos en la niñez generalmente no tiene relación con el riesgo de desarrollar diabetes tipo 1 [29]. Estudios futuros deberían analizar los efectos de las múltiples exposiciones a antibióticos de amplio espectro durante el segundo año de vida.
Antibióticos y neoplasias
En el caso de las neoplasias gastrointestinales, el uso de penicilina está relacionado con un riesgo elevado de cáncer de esófago, de estómago y de páncreas [30]. Esta asociación aumentaba con la cantidad de ciclos de antibióticos. El cáncer de pulmón aumentaba con el uso de penicilina, de cefalosporinas o de macrólidos. El riesgo de cáncer de próstata aumentaba ligeramente con el uso de penicilina, de quinolonas, de sulfonamidas y de tetraciclinas. El riesgo de cáncer de mama está ligeramente relacionado con la exposición a sulfonamidas. No hubo relación entre la exposición a antivirales y fungicidas, y el riesgo de cáncer [30].
Conclusión
En ocasiones, los antibióticos son inevitables y, a veces, salvan vidas. Sin embargo, también provocan disbiosis intestinal, que se relaciona con resultados adversos, como DAA. Es fundamental utilizar los antibióticos con prudencia, no solo para reducir la propagación de organismos resistentes a los antibióticos, sino también para minimizar las consecuencias metabólicas a largo plazo potencialmente perjudiciales de la exposición temprana a antibióticos. La administración de algunas cepas específicas de probióticos, como Saccharomyces boulardii, reduce el riesgo de desarrollar DAA. No se ha validado mediante estudios si los probióticos pueden reducir el riesgo de desarrollar otros efectos adversos de la disbiosis intestinal.
Obesidad materna durante el embarazo y tipo de parto
Revisión de prensa
Por el Pr. Ener Cagri Dinleyici
Servicio de Pediatría, Facultad de Medicina, Universidad Eskisehir Osmangazi, Eskisehir, Turquía
Condicionan la composición de la microbiota y el peso del niño a la edad de uno y tres años
La obesidad es un problema de salud global tanto en niños como en adultos; por consiguiente se ha evaluado la composición de la microbiota y las alteraciones en pacientes con obesidad. Hay una tendencia creciente que favorece los partos por cesárea en todo el mundo. El sobrepeso o la obesidad de la madre durante el embarazo están asociados a mayores tasas de parto por cesárea, y los niños que nacen por cesárea tienen más probabilidades de sufrir obesidad que quienes nacen en un parto vaginal.
Microbioma y peso estudiados en 935 parejas de madres e hijos
La composición de la microbiota y las alteraciones en pacientes con obesidad y en recién nacidos por cesárea se han evaluado anteriormente [1]. El estudio Canadian Healthy Infant Longitudinal Development (CHILD) es un estudio prospectivo y longitudinal de cohortes de nacimiento diseñado para recabar información en los momentos que se consideran especialmente críticos para la salud y el desarrollo de los niños, en términos de definición de la influencia de la genética, la epigenética y el microbioma durante los primeros años de vida [2]. Hein Tun y colaboradores [1] incluyeron a 935 parejas de madre e hijo en el estudio y evaluaron el peso materno durante el embarazo, la composición de la microbiota intestinal del niño (incluida la secuenciación del ARN ribosómico 16S) después de una mediana de un mes, y las valoraciones z del índice de masa corporal en función de la edad y el sexo, a la edad de uno y tres años. Sus resultados revelaron que el 7,5% de los niños tenían sobrepeso con un año de edad y el 10,4%, a los tres años.
Los niños nacidos por vía vaginal con madres con sobrepeso u obesidad tenían el triple de posibilidades de presentar sobrepeso a la edad de un año, mientras que los niños nacidos por cesárea y madre con sobrepeso tenían un riesgo cinco veces mayor de presentar sobrepeso a la edad de un año. Un riesgo parecido era observado a los tres años de edad. La presencia abundante de especies de Firmicutes en la microbiota intestinal del niño, sobre todo de Lachnospiraceae, está asociada a un peso materno excesivo antes del embarazo, y a un peso excesivo durante la infancia a uno y tres años. Los géneros de Lachnospiraceae implicados eran diferentes entre los niños nacidos por parto vaginal y los nacidos por cesárea.
¿Existe una transmisión intergeneracional del sobrepeso y la obesidad a causa del parto por cesárea?
Este estudio de 935 parejas de madre e hijo aportó datos sobre una nueva vía mediadora secuencial, en la que intervienen el tipo de parto y la mayor abundancia de Lachnospiraceae, en la transmisión intergeneracional del sobrepeso y la obesidad, sobre todo en el parto por cesárea. Es de conocimiento general que la obesidad de las mujeres en edad reproductiva es importante tanto para su salud como para la de sus hijos.
Hanson y colaboradores [3] resaltaron que las acciones para reducir o prevenir la obesidad antes de la concepción y durante el embarazo podrían contribuir, de manera sustancial, a lograr los Objetivos de Desarrollo Sostenible en términos de salud, bienestar, productividad y equidad para las generaciones actuales y futuras. En cuanto a los avances actuales hacia el conocimiento del microbioma, su composición tendrá un papel importante sobre el bienestar en el futuro.
La microbiota intestinal modula la respuesta tumoral en pacientes con cáncer
Revisión de prensa
Por el Pr. Ener Cagri Dinleyici
Servicio de Pediatría, Facultad de Medicina, Universidad Eskisehir Osmangazi, Eskisehir, Turquía

El 4 de febrero de 2018, Día Mundial del Cáncer, la Organización Mundial de la Salud declaró en su sitio web lo siguiente: “Casi todas las familias del mundo están afectadas por el cáncer, que en la actualidad es responsable de casi una de cada seis muertes en todo el mundo. En el Día Mundial del Cáncer (4 de febrero), la OMS pone de relieve que el cáncer no tiene por qué ser una sentencia de muerte, ya que tenemos la capacidad de reducir el lastre que representa, y mejorar la supervivencia y la calidad de vida de las personas que viven con la enfermedad”. [1]..
En los 10 últimos años, se han producido avances espectaculares para los pacientes con cáncer gracias al uso de nuevas estrategias terapéuticas, entre las cuales se incluyen inhibidores del control inmunitario que tienen como objetivo al antígeno asociado al linfocito T citotóxico (CTLA-4) y a la proteína de muerte programada 1 (PD-1). Sin embargo, muchas veces las respuestas terapéuticas a estas nuevas modalidades de tratamiento son heterogéneas, y se ha observado que hay algunos pacientes que no responden al tratamiento. Se ha propuesto que el microbioma intestinal podría constituir un importante factor del huésped en los pacientes sin una buena respuesta, junto con la genómica del tumor. Los estudios anteriores sobre la microbiota y el cáncer se han centrado sobre todo en las alteraciones de la microbiota intestinal en los pacientes oncológicos (oncobioma) o en los precursores de la microbiota, para detectar los cánceres en estadio inicial, principalmente los colorrectales. Sin embargo, han aparecido nuevos y prometedores resultados sobre la influencia de la microbiota intestinal en las respuestas inmunitarias antitumorales. En el primer número de Science de este año se publicaron dos nuevos estudios.
-
Gopalakrishnan y colaboradores evaluaron el microbioma intestinal y oral en 112 pacientes con melanoma maligno que recibían inmunoterapia anti-PD-1, y compararon la composición inicial de la microbiota en pacientes con cáncer que respondían al tratamiento y en otros que no respondían correctamente. Pusieron de manifiesto diferencias significativas en la diversidad y la composición de la microbiota intestinal de los pacientes con y sin respuesta. Cabe destacar que en los pacientes con respuesta se observó una diversidad alfa significativamente mayor y una abundancia relativa de Ruminococcaceae/ Faecalibacterium, y se ha propuesto que esta composición favorable de la microbiota intestinal podría potenciar la inmunidad sistémica y antitumoral en los pacientes con melanoma. Los pacientes con una diversidad baja y una abundancia relativamente mayor de Bacteroidales (microbioma intestinal desfavorable) presentan peores respuestas inmunitarias antitumorales.
-
Matson y colaboradores evaluaron también la composición de la microbiota intestinal inicial en pacientes con melanoma metastásico, antes de recibir tratamiento anti-PD-L1. Se observó que, en quienes respondieron al tratamiento, Bifidobacterium longum, Collinsella aerofaciens y Enterococcus faecium eran los miembros predominantes de la microbiota. Matson y colaboradores proponen que el microbioma comensal podría tener un impacto mecanístico sobre la inmunidad antitumoral de los pacientes con melanoma metastásico A la luz de los resultados de los dos estudios clínicos anteriores, se cree que la microbiota intestinal inicial podría tener un papel esencial en la mediación de la respuesta estimuladora inmunitaria en pacientes con melanoma que reciben inmunoterapia, como el tratamiento anti-PD-L1. Se necesitan más estudios prospectivos para revelar las interacciones exactas entre el microbioma y el cáncer, no solo en los pacientes con melanoma, sino en términos de posible relevancia para todos los tipos de cáncer y las diferentes estrategias terapéuticas.
1 World Cancer Day 2018. http://www.who.int/cancer/world-cancer- day/2018/en/










