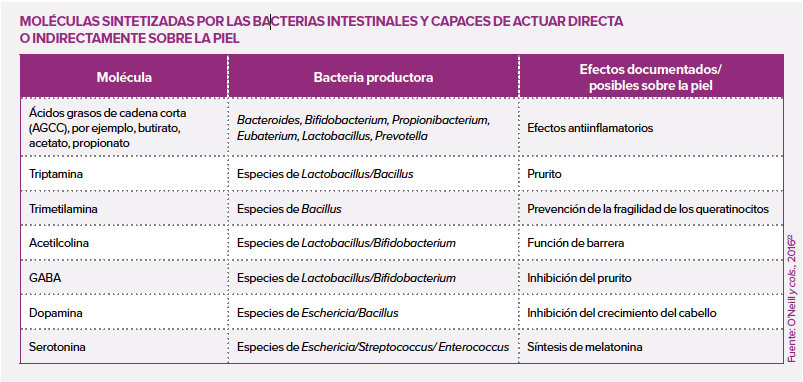
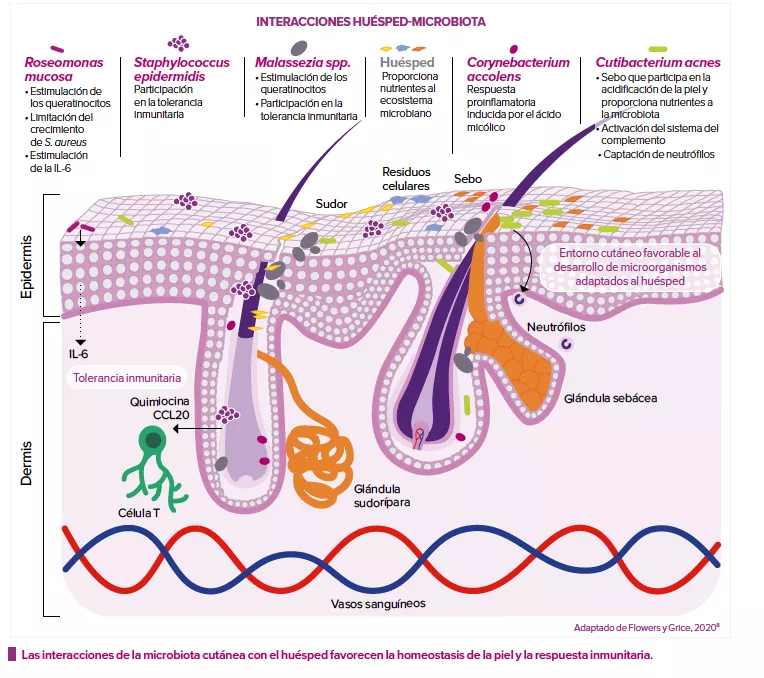
El cáncer de pulmón es la primera causa de fallecimiento por cáncer en el mundo. Si bien el tabaquismo activo constituye el principal factor de riesgo, el 25% de los casos se declaran en no fumadores. Un porcentaje elevado que no puede explicarse totalmente por los principales riesgos identificados: tabaquismo pasivo, contaminación, antecedentes familiares... Además del papel de la microbiota intestinal en la aparición de ciertos tipos de cáncer gastrointestinal, otros ecosistemas microbianos se han asociado también a un riesgo de cáncer. En este estudio, los autores se interesaron por la microbiota oral, cuya composición y capacidad de colonizar las vías respiratorias podrían participar en la aparición de un carcinoma bronquial.
Cuánto más pobre la microbiota, mayor el riesgo
Su estudio prospectivo se basó en el seguimiento prolongado de más de 136 000 habitantes de Shanghái que nunca habían fumado (61 500 hombres y 75 000 mujeres), con visitas de control cada 2 a 3 años. Se analizó una muestra de saliva, obtenida en el momento de la admisión en el estudio, en todos los pacientes que declaraban un cáncer de pulmón y en un número idéntico de controles que reunían las mismas características de sexo, edad, fecha y hora de toma de la muestra, tratamiento antibiótico previo... Al final, la comparación realizada después de la secuenciación metagenómica se efectuó en 114 pacientes y otros tantos controles. Dicha comparación reveló un riesgo tanto más importante de desarrollar un cáncer de pulmón cuanto que la microbiota oral carecía de diversidad bacteriana.
Cuando la abundancia (de Firmicutes) arruina…
La composición intrínseca de la microbiota oral también parece desempeñar un papel preponderante. En esta población de no fumadores, un aumento de la cantidad relativa de Spirochaetes y/o Bacteroidetes tiende a indicar un riesgo menor. En cambio, la abundancia de bacterias pertenecientes al filo Firmicutes y, en particular, de Lactobacillales, se asocia a una mayor probabilidad de desarrollar un cáncer pulmonar. Los autores precisan que estos resultados coinciden con los de anteriores estudios, que demostraron una relación entre Firmicutes y enfermedades respiratorias (enfermedad pulmonar obstructiva crónica [EPOC], carcinoma escamoso de cabeza y cuello, cáncer pulmonar…).
Investigaciones complementarias para precisar el ámbito de acción de la microbiota ORL
Esta caracterización a gran escala de la microbiota oral ofrece un nuevo enfoque sobre la etiología del cáncer de pulmón en los no fumadores. La homogeneidad geográfica del estudio refuerza la pertinencia de los hallazgos, pero limita su alcance. Se requieren trabajos complementarios, realizados en otras poblaciones y en otros lugares, para precisar el papel de la microbiota ORL en el desarrollo del carcinoma bronquial y otras enfermedades respiratorias.