Comment expliquer les « TSA », les Troubles du Spectre Autistiques ? La question anime la communauté scientifique depuis des décennies. Sans tout expliquer sur l’origine de cette pathologie qui se caractérise par des difficultés à se sociabiliser, à communiquer ou encore par troubles obsessionnels compulsifs (TOC), l’intestin pourrait être un des éléments de réponse. Et plus particulièrement les milliards de bactéries et autres micro-organismes qui le peuplent… pour le meilleur et pour le pire...
Une liaison dangereuse : désordres intestinaux et TSA
Depuis la description ce trouble en 1943, toute une liste de symptômes associée aux TSA a été identifiée. Entre autres, les troubles intestinaux (diarrhée, constipation, côlon irritable…) font partie des désordres biologiques les plus classiques. Les enfants atteints de TSA souffrent 3 à 4 fois plus de perturbations gastro-intestinales. Et la sévérité de l’autisme va souvent de pair avec les dérèglements intestinaux les plus graves ; et vice versa. Pour enfoncer le clou, des chercheurs ont même montré qu’en traitant le trouble gastro-intestinal le patient autiste montrait une amélioration dans son comportement. Ils se sont alors intéressés aux mécanismes derrière ces désordres gastrointestinaux et ont regardé de plus près le microbiote intestinal.
Un microbiote qui se prend pour le cerveau ?
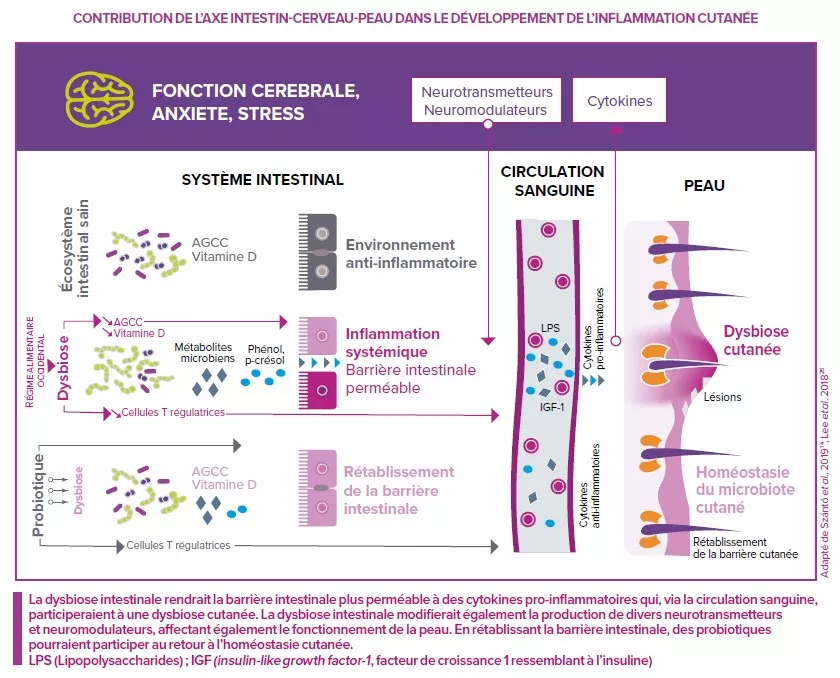
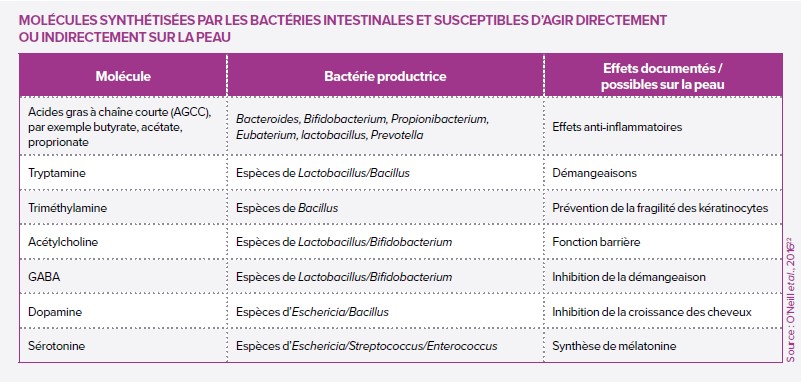
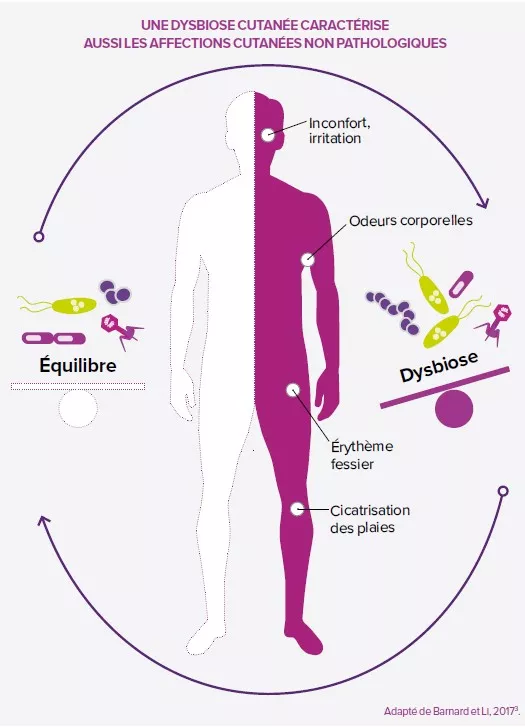
Constat n°1 : les patients autistes présentent souvent une flore intestinale altérée (dysbiose) : pauvre en bactéries bénéfiques et plus riches en microbes impliqués dans certain désordres intestinaux (diarrhées, constipation…). Et ces derniers, non contents de tordre l’intestin, produisent aussi des molécules dites « signales » utilisées par l’intestin et le cerveau pour communiquer. En clair, produit en trop grande quantité, ces molécules pourraient déséquilibrer la communication et entrainer des troubles du comportement rencontrés dans les TSA.
Une passoire à la place de l’intestin ?
Constat n°2 : la barrière intestinale ne joue plus son rôle, celle d’empêcher les microbes, allergènes et autres molécules étrangères de rentrer dans le sang. Conséquence : une activation du système immunitaire qui entraine des réactions inflammatoires. En effet, de nombreux patients autistes présentent une perméabilité intestinale, une inflammation intestinale, neuronale et des troubles intestinaux associés à une réponse au stress exacerbée. Si ces données soutiennent un lien étroit entre l’intestin et cerveau dans les TSA, il n’en demeure pas moins que les mécanismes par lesquels les désordres gastro-intestinaux contribuent aux TSA restent encore très complexes. Des recherches complémentaires sont nécessaires pour identifier des approches thérapeutiques capables de traiter ces problèmes intestinaux et d’améliorer la qualité de vie des patients.

 L’anxiété chronique possiblement influencée par les bactéries intestinales ?
L’anxiété chronique possiblement influencée par les bactéries intestinales ?