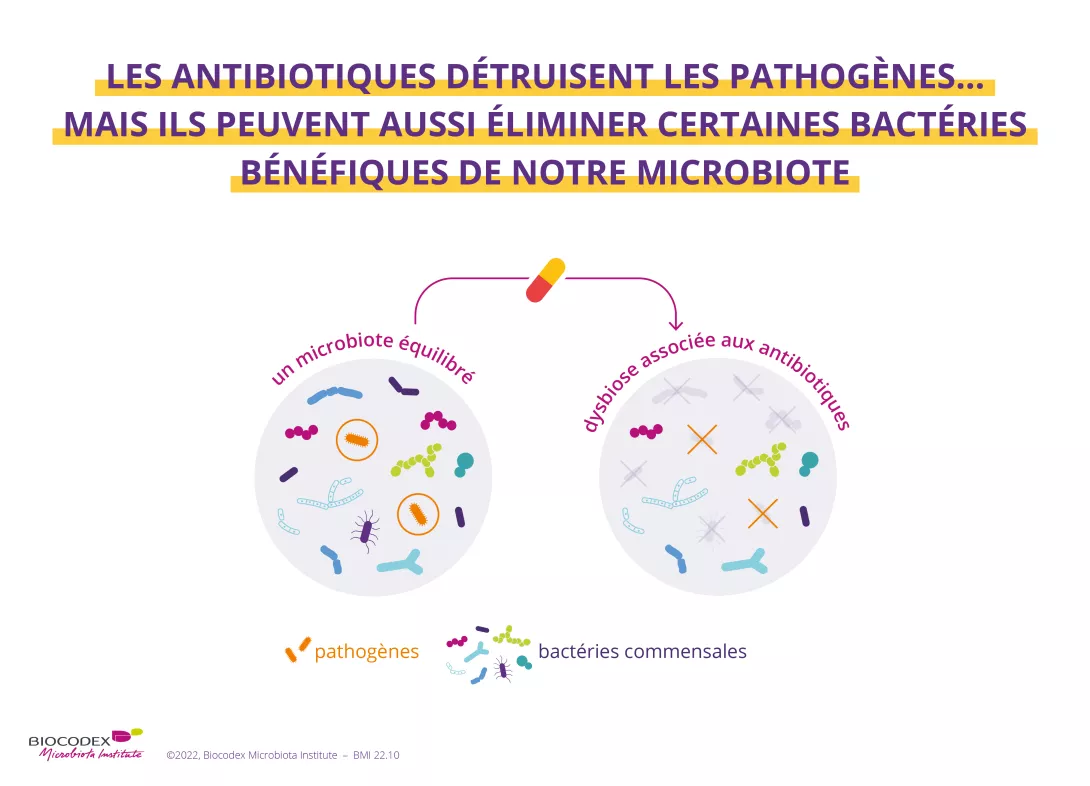
Le diabète de type 1 (DT1) est une maladie auto-immune conduisant à la destruction des cellules β pancréatiques. Des données chez la souris suggèrent que des interactions entre le microbiote intestinal et le système immunitaire inné seraient impliquées dans le développement de la maladie, dont la progression pourrait être ralentie par une transplantation de microbiote fécal (TMF).
Transplantation autologue versus allogénique
Dans un essai randomisé contrôlé, des patients récemment diagnostiqués DT1 ont ainsi reçu 3 TMF par sonde naso-duodénale à t = 0, 2 ou 4 mois, soit à partir de leurs fèces (TMF autologue, n=10), soit à partir de fèces de donneurs sains (TMF allogénique, n=10). Dans l’année suivant la première TMF, les chercheurs évaluaient la fonction résiduelle des cellules β (via la sécrétion de peptide C en réponse à un repas test), ainsi que les modifications métaboliques, immunitaires et du microbiote induites par les deux TMF.
La fonction pancréatique préservée
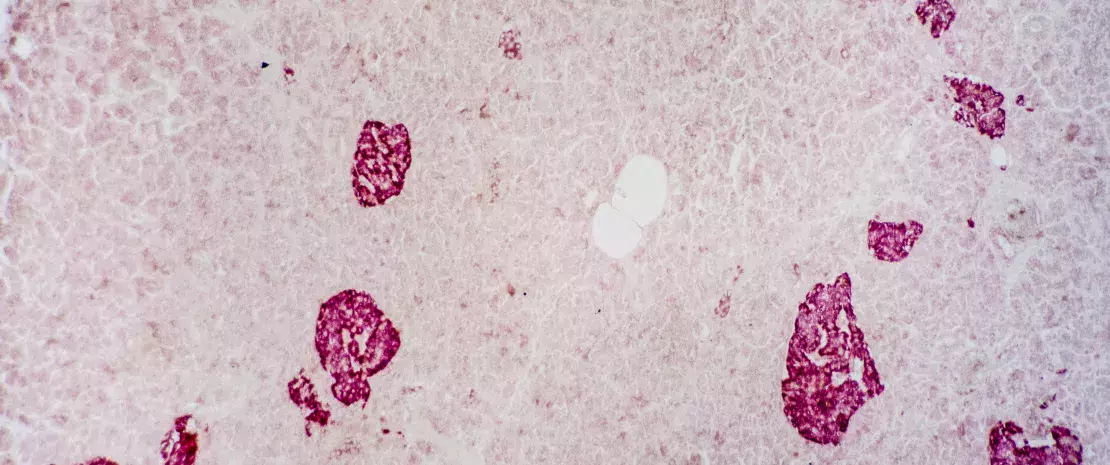
Contrairement aux attentes des chercheurs, un an après la première TMF, la fonction des cellules β était préservée dans le groupe autologue. Elle était en revanche détériorée dans le groupe allogénique, cependant moins que chez des patients DT1 sans traitement dans la première année suivant le diagnostic1. Selon les chercheurs, les effets bénéfiques de la TMF seraient plus prononcés et durables quand la compatibilité immunologique entre le donneur et l’hôte est élevée.
Desulfovibrio piger impliqué ?
Des modifications du microbiote s’avéraient associées à certaines modifications métaboliques et immunitaires. Ainsi, au niveau duodénal, Prevotella spp. était inversement corrélée à la fonction résiduelle des cellules β. Au niveau colique, Desulfovibrio piger augmentait largement suite à la FMT autologue uniquement. Son abondance était associée à une meilleure fonction résiduelle des cellules β, mais aussi aux taux circulants de 1-arachidonoyl-GPC (A-GPC), un métabolite microbien lui-même associé à une production accrue de peptide C. De plus, l’abondance de D. piger était négativement corrélée aux taux de certains lymphocytes T impliqués dans l’auto-immunité. Traduction des auteurs ? D. piger pourrait freiner l’auto-immunité en supprimant ces lymphocytes via la production d’A-GPC. Des multiples corrélations mises en évidence, les chercheurs retiennent des pistes mécanistiques à approfondir pour préciser les effets de la TMF sur le DT1, ainsi que le potentiel thérapeutique nouvellement identifié de certaines espèces.
1. Overgaard AJ, Weir JM, Jayawardana K, et al. Plasma lipid species at type 1 diabetes onset predict residual beta-cell function after 6 months. Metabolomics 2018;14:158; Lachin JM, McGee PL, Greenbaum CJ, et al. Sample size requirements for studies of treatment effects on beta-cell function in newly diagnosed type 1 diabetes. PLoS One 2011;6:e26471.