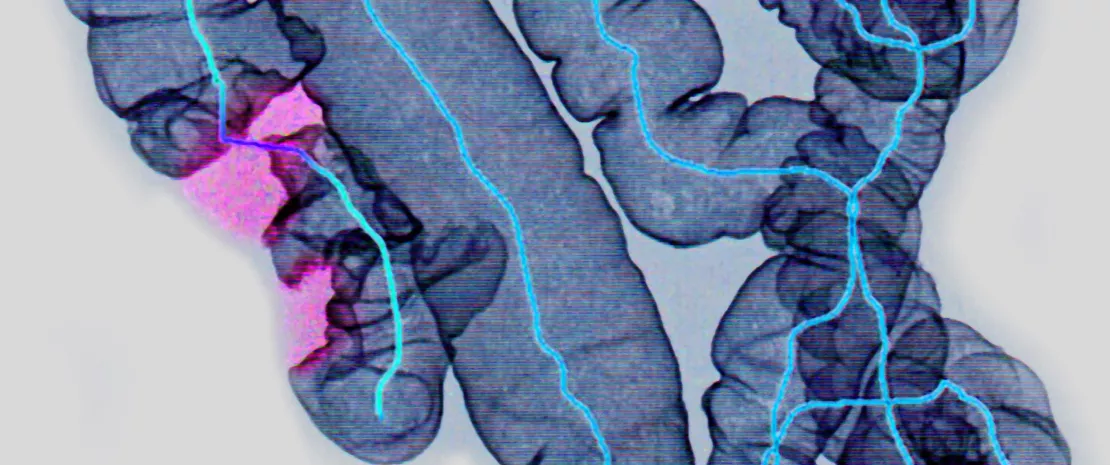
As formações tumorais no cancro colorretal (CCR) fazem parte de um processo longo, o que explica que os sinais clínicos só apareçam num estado avançado da doença, embora sejam curáveis quando tratados precocemente. Existem fortes indícios de que a microbiota intestinal esteja envolvida neste processo, com base em dados genómicos e metabolómicos*. Assim, é importante perceber melhor o seu papel, de uma perspetiva etiológica e diagnóstica. Por este motivo, uma equipa japonesa realizou análises metagenómicas (n = 616) e metabolómicas (n = 406) em amostras fecais de doentes, em diferentes estadios de neoplasia colorretal, que foram submetidos a uma colonoscopia. Os doentes foram divididos em nove grupos: do grupo controlo ao grupo com CCR em estadio IV, passando pelos estadios iniciais, como múltiplos pólipos adenomatosos e carcinoma intramucoso (estadio 0).
Alterações na microbiota ocorreram desde os estadios iniciais
Graças à técnica avançada de sequenciamento utilizada (shotgun), os resultados revelaram alterações na microbiota e no metaboloma, não apenas em doentes com lesões avançadas, mas também em estadios iniciais. Foram observadas duas mudanças significativas na composição da microbiota intestinal, durante o desenvolvimento do CCR: por um lado, um aumento progressivo na quantidade relativa de algumas espécies (como Fusobacterium nucleatum spp., Solobacterium moorei...), qualquer que seja o estadio da doença e, por outro lado, coexistência e aumento de outras espécies (como Actinomyces odontolyticus) apenas em doentes em estadio inicial. Além disso, o aumento da proliferação de outras espécies pode caracterizar a progressão do CCR, como Parvimonas micra do estadio I e Bilophila worthsworthia no estadio III / IV.
Confirmado o papel dos ácidos biliares fecais
Também foram observadas diferenças significativas no nível do metaboloma entre os grupos que poderiam ser usados para distinguir entre doentes saudáveis e aqueles com alto risco de CCR. Em doentes com carcinoma intramucoso, foram encontrados níveis significativamente mais altos de aminoácidos de cadeia ramificada (isoleucina, leucina e valina), fenilalanina, tirosina e glicina. Os ácidos biliares, incluindo o ácido desoxicólico, foram significativamente superiores em todos os doentes em estadio inicial da doença, confirmando a correlação positiva já reportada entre a concentração fecal de ácidos biliares desoxicólicos secundários e o aumento do risco de CCR. Todos estes resultados, obtidos numa grande coorte, mostram que alterações ocorrem na microbiota intestinal assim que surgem sinais de alerta de cancro colorretal, provocando alterações nas concentrações fecais de alguns metabólitos.
* Metabolómica é o estudo de metabolitos derivados do corpo ou do meio ambiente e ocorre a jusante da genómica (estudo de todos os genes), entre outros.