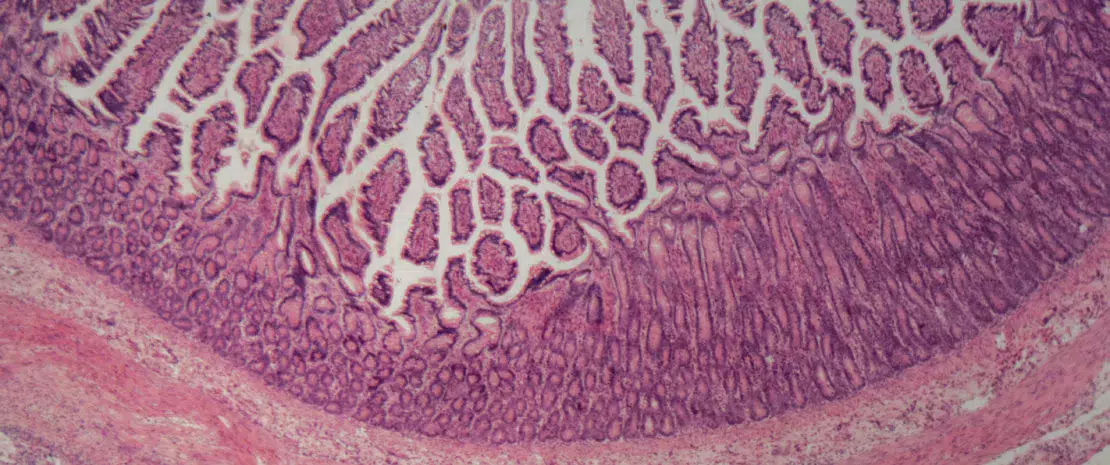
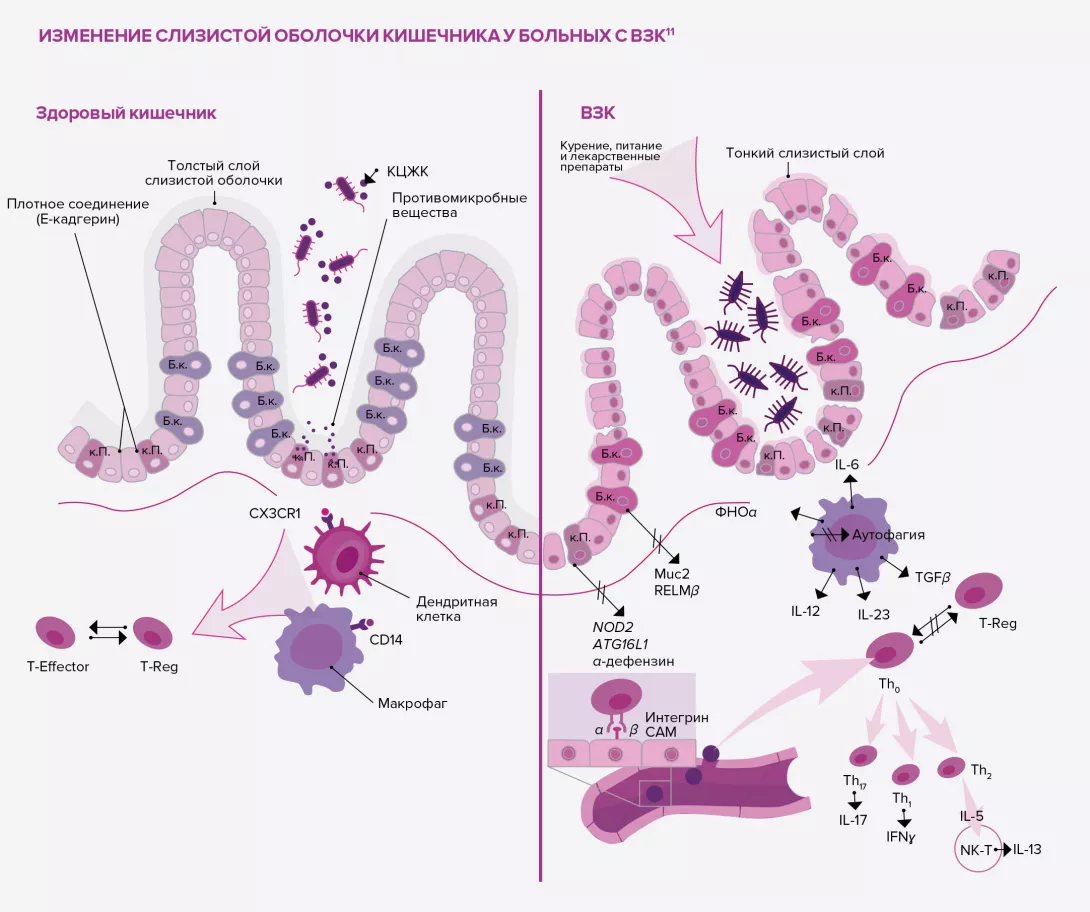
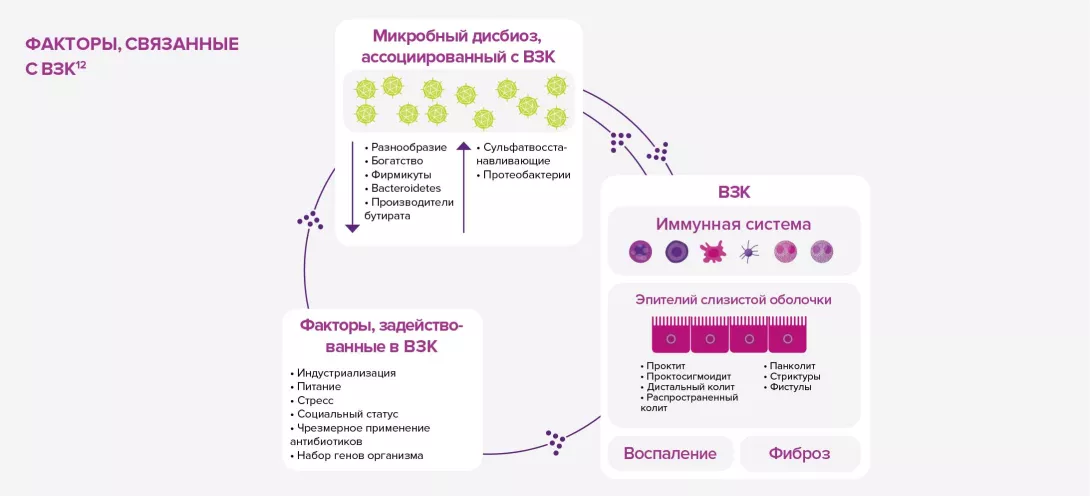
За последние несколько лет частота применения пробиотиков значительно увеличилась. Во многом данной тенденции способствует возросшее число работ, посвященных этим «благотворным» микроорганизмам. Однако не все микроорганизмы можно называть «пробиотиками»: они должны уметь выживать в ЖКТ, выдерживать воздействие желудочной кислоты и пищеварительных ферментов, временно заселять кишечник и обладать доказанной эффективностью. Этот термин применим лишь к тем микроорганизмам, которые устойчивы к разрушению, безвредны для человеческого организма и способны облегчать симптомы заболевания. Обычно они продаются в виде пищевых добавок или лекарственных средств, в зависимости от эффективности в отношении облегчения симптомов и степени их безопасности. В их состав входит один или несколько штаммов или комбинация нескольких видов, и они выпускаются в разных формах: в капсулах, порошках для приготовления раствора, диспергируемых порошках для приема внутрь, таблетках и т. д.
Два основных вида
Обзор научной литературы с целью оценки применения пробиотиков в профилактике и лечении желудочно-кишечных расстройств у детей показал, что их польза специфична для каждого штамма и зависит от типа инфекции8. В настоящее время два микроорганизма представляются эффективными в отношении симптомов гастроэнтерита с точки зрения сокращения длительности их проявления: дрожжи Saccharomyces boulardii, а также бактерии Lactobacillus rhamnosus GG (LGG). В более широком смысле эти пробиотики, как представляется, ослабляют симптомы, особенно при использовании на ранней стадии инфекции, и если последняя имеет вирусное происхождение. В случае диареи, спровоцированной антибиотиками, S. boulardii и L. rhamnosus GG также могут оказывать благотворное влияние. Однако при профилактике рецидивов инфекций, обусловленных Clostridium difficile, и диареи путешественников влияние на симптомы оказывает, судя по всему, только S. boulardii.
Более быстрое восстановление!
В случае гастроэнтерита, вызванного ротавирусом, эти пробиотики сокращают длительность эпизода на один-два дня2. Они способствуют снижению количества молекул, поддерживающих воспалительный процесс, стимулируют иммунный ответ и способствуют пролиферации и/или миграции клеток кишечника, отвечающих за транспорт питательных веществ, и тем самым облегчают усвоение глюкозы и, как следствие, воды. Помимо профилактики диареи у детей, получающих антибиотики или находящихся на госпитализации, эти штаммы (S. boulardii в числе прочих) предотвращают 85 % эпизодов диареи, связанных с употреблением зараженной пищи или воды9 (диарея путешественников). Для эффективности профилактики прием пробиотиков следует начинать за несколько дней до отъезда и продолжать в течение всего путешествия и даже после.