ВОЗДЕЙСТВИЕ АНТИБИОТИКОВ И ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ КИШЕЧНИКА У ДЕТЕЙ
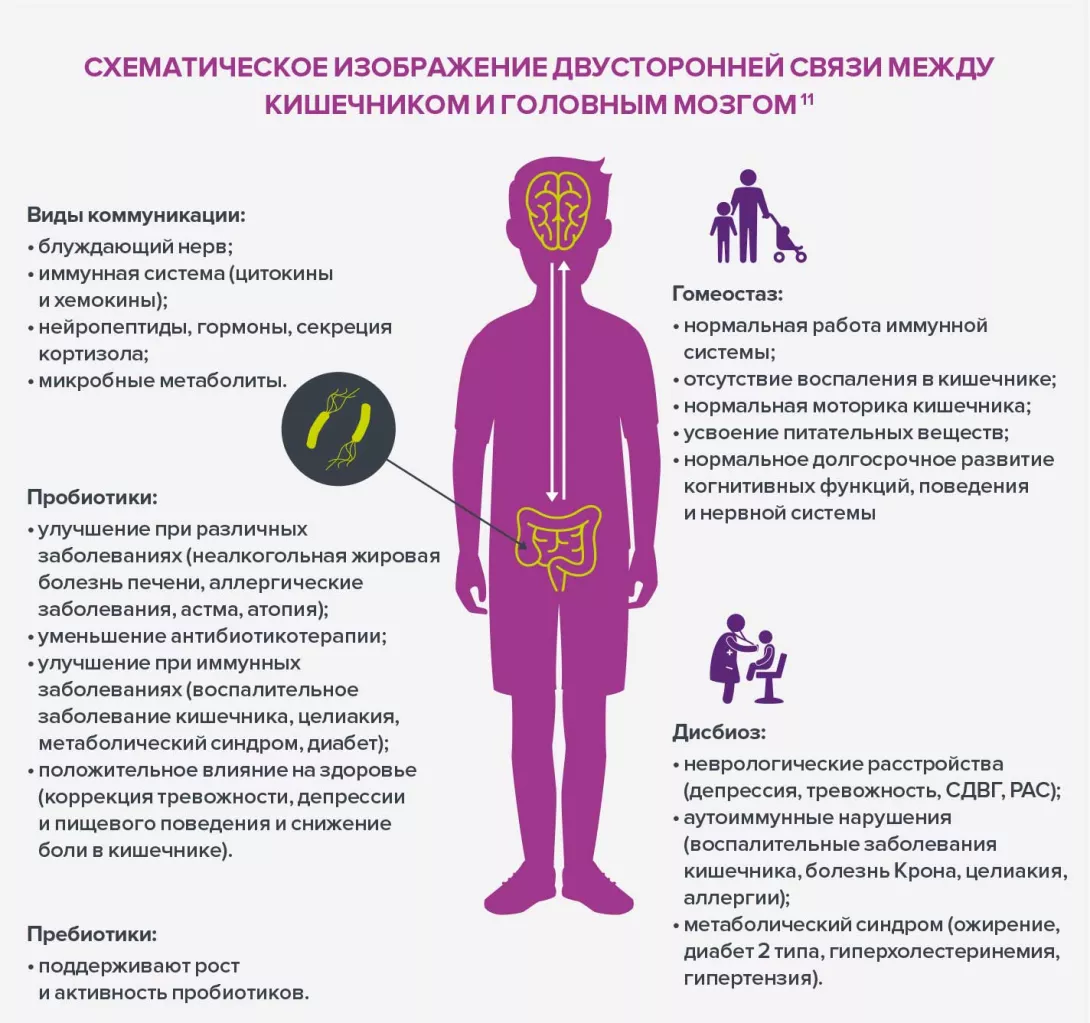
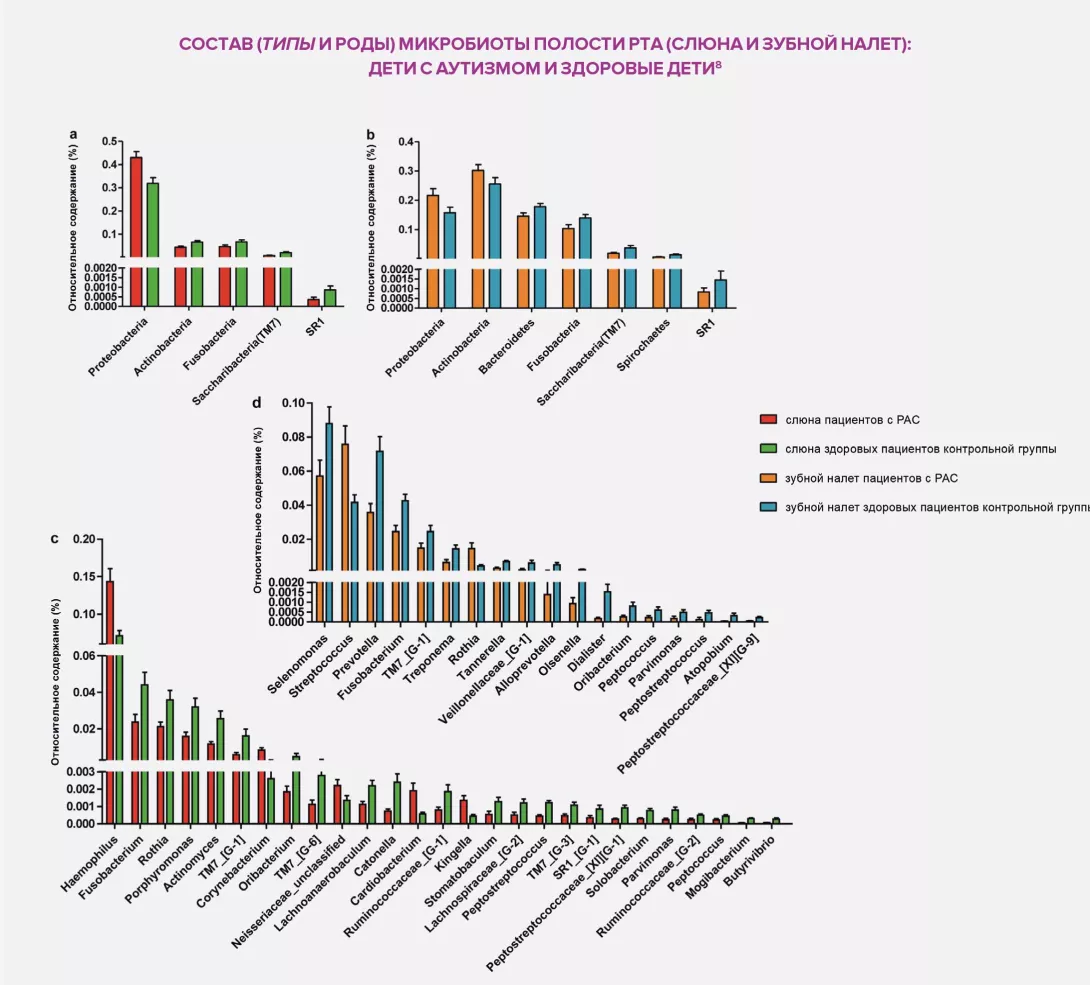
Проблема избыточного веса подчеркивает сложность выяснения влияния дисбактериоза в некоторых областях медицины. Более детально были изучены причинные связи в области гастроэнтерологии, где была установлена связь между составом микробиоты кишечника и ВЗК. Эта связь приводит к тому, что исследователи чаще обращают внимание на дисбиоз в попытке понять расстройства с недостаточно ясной этиологией, в особенности язвенный колит (ЯК) и болезнь Крона у детей раннего возраста (младше шести лет), частота возникновения которых в мире неуклонно растет. Поскольку причина этого роста не может быть объяснена генетическими факторами и факторами окружающей среды, предполагается, что такие заболевания связаны с нарушением микробиоты.
В ДВА РАЗА БОЛЕЕ ВЫСОКИЙ РИСК ВЗК ПОСЛЕ ЛЕЧЕНИЯ АНТИБИОТИКАМИ ИНТРАНАТАЛЬНО
Шведские ученые3 изучили эту гипотезу, проведя исследование на когорте из 827 239 детей, родившихся с 2006 по 2013 год. Это был подробный анализ, основанный на перекрестной проверке Шведской системы учета родившихся, пациентов и назначенных лекарств. В целом 17 % исследуемых подвергались воздействию антибиотиков интранатально (в том числе 5 % повторно), 65 % – после родов, большая часть из них неоднократно (7 из 10). Пятьдесят один ребенок страдал болезнью Крона или ЯК. В сравнении с контрольной группой у детей, которые подвергались воздействию антибиотиков во время беременности, был повышен риск (скорректированное ОР4 = 1,93) развития ВЗК у детей.
ВОЗДЕЙСТВИЕ НА ПЛОД
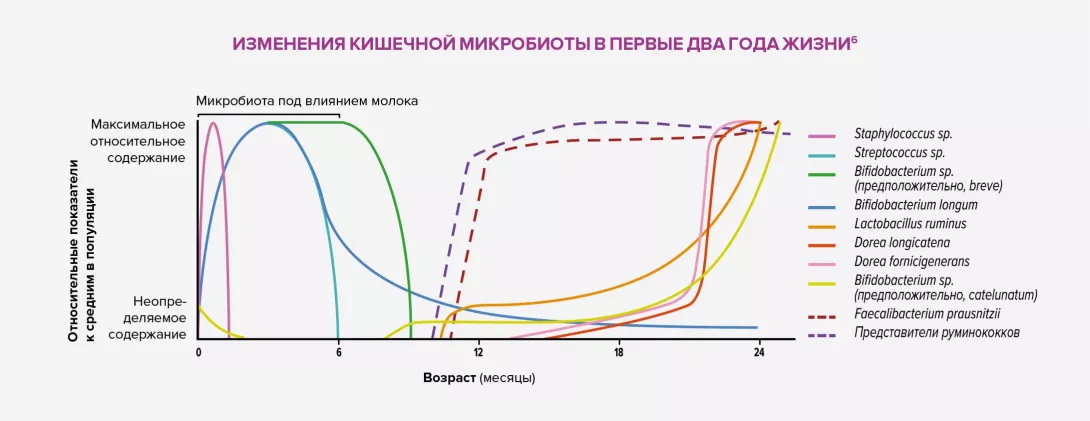
Считается, что внутриутробное воздействие антибиотиков способно нарушить раннюю бактериальную колонизацию у детей, что проявляется низкой концентрацией комменсальных бактерий, в частности Faecalibacterium prausnitzii, и руминококков и увеличением количества патогенных бактерий. Такой дисбиоз может провоцировать значительные физиологические изменения из-за взаимодействия между микробиотой и организмом человека путем продукции короткоцепочечных жирных кислот5 (в частности, бутирата), индукции иммунной системы слизистой кишечника, стимуляции периферической нервной системы и поддержания функции кишечного барьера. Все эти дисфункции могут спровоцировать воспалительные нарушения.
СОВЕРШЕНСТВОВАНИЕ НАЗНАЧЕНИЯ АНТИБИОТИКОВ С ЦЕЛЬЮ СОХРАНЕНИЯ МИКРОБИОТЫ
Упомянутые выше данные, а также данные, полученные в результате возрастающего числа исследований и публикаций показывают, что разнообразная микробиота с высоким соотношением комменсальных/ патогенных бактерий способствует адекватному развитию детей, снижая риск возникновения некоторых заболеваний, в особенности метаболических и воспалительных. Это наблюдение не призывает к сокращению применения антибиотикотерапии, которая во многих случаях незаменима по своей эффективности, что подтверждают все врачи. Однако хорошими стратегиями для снижения влияния антибиотиков и выработки устойчивости у кишечной микробиоты с целью сохранения здоровья детей в краткосрочной и долгосрочной перспективе являются оптимизация назначений, спектра используемых препаратов, продолжительности лечения и путей введения.