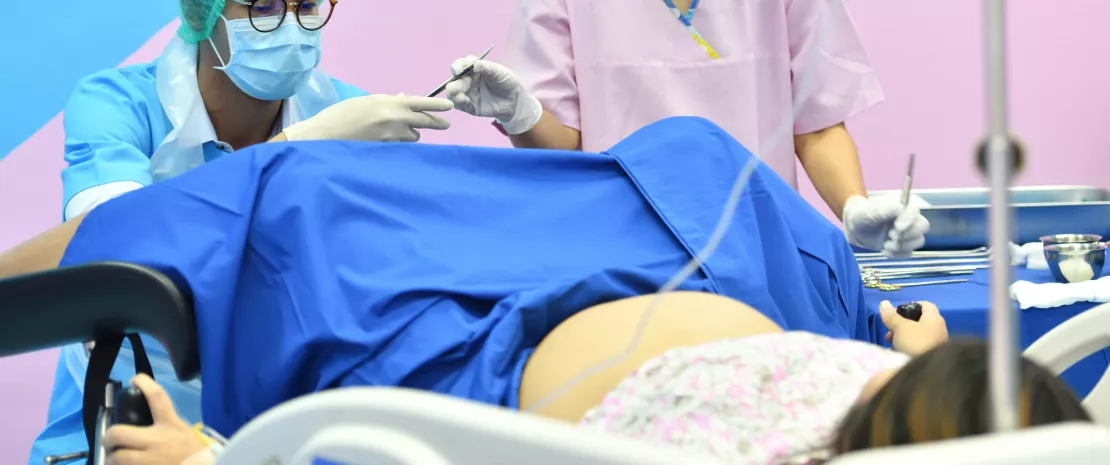
Естественные роды содействуют передаче материнской микробиоты, состав которой влияет за развитие иммунной системы новорожденных, особенно за счет биосинтеза липополисахаридов.
Во всем мире 19,1 % родов выполняется путем кесарева сечения. В Европе этот показатель достигает 25 %, в связи с чем возникают этические проблемы: такой способ родоразрешения часто используют по соображениям удобства, а не по медицинским показаниям. Мы уже знаем, что способ родоразрешения влияет на состав кишечной микробиоты у новорожденных, в основном из-за возможного контакта с вагинальной, кожной (и иногда фекальной) микрофлорой матери и применения антибиотиков во время кесарева сечения. Поскольку первые дни после родов являются критически важными для развития иммунной системы новорожденных, международная группа ученых обратилась к изучению кишечных бактерий, передаваемых от матери ребенку в зависимости от способа родоразрешения. Финальным этапом исследования стал анализ бактериальных генов и их функций.
Естественные роды: стимуляция биосинтеза ЛПС
Главный вывод исследования с участием 33 новорожденных состоит в том, что у рожденных естественным путем детей повышено содержание грамотрицательных бактерий (Bacteroides и Parabacteroides), которые улучшают физиологические функции организма. С другой стороны, кесарево сечение способствует контакту новорожденных с микроорганизмами, находящимися на поверхности кожи матери, и передаче Staphylococcus, содержание которого повышено в стуле у детей, рожденных таким способом. По мнению ученых, содержание этих бактерий у детей, рожденных естественным путем, может быть выше, чем у рожденных путем кесарева сечения, из-за более активной стимуляции биосинтеза липополисахаридов (ЛПС) (которые входят в состав внешней мембраны грамотрицательных бактерий). ЛПС являются эндотоксинами, способствующими продукции провоспалительных цитокинов (ФНО-α и ИЛ-18) в плазме. Эти цитокины повышены у детей, рожденных естественным путем.
Иммуностимулирующее действие подтверждено in vitro
Выделение ЛПС из стула детей, рожденных естественным путем или путем кесарева сечения, для стимуляции in vitro первичных иммунных клеток человека подтвердило, что при использовании кесарева сечении продукция ФНО-α и ИЛ-18 снижена. Это говорит о снижении иммуностимулирующего действия кишечной микробиоты у детей, рожденных путем кесарева сечения, из-за отсутствия контакта с вагинальной микрофлорой матери и неполной вертикальной передачи некоторых штаммов бактерий новорожденным. В долгосрочной перспективе может увеличиться риск развития воспалительных, иммунных, метаболических нарушений и даже хронических заболеваний. Как бы то ни было, полученные результаты необходимо проверить на расширенных выборках с увеличенным периодом наблюдения. В результате мы получим более полное представление о роли первого контакта с микробной средой в формировании врожденного и приобретенного иммунного ответа.