Microbiote infantile : le mode d’allaitement maternel compte
Entre autres facteurs, l'utilisation d'un tire-lait serait moins bénéfique pour la santé et le développement des nourrissons que l’allaitement au sein, selon une étude canadienne portant sur la composition du microbiote du lait maternel.
Le microbiote intestinal La transplantation fécale pour restaurer le microbiote des bébés nés par césarienne ? Microbiote, allaitement et puberté précoce Une antibiothérapie prophylactique péri-partum appauvrit le lait maternel en Bifidobacterium
Schizophrénie et microbiote : un lien confirmé ?
Une nouvelle étude chinoise vient étayer l’hypothèse d’un lien entre un déséquilibre du microbiote intestinal (dysbiose) et la schizophrénie, une maladie psychiatrique qui touche entre 0,5 et 1 % de la population mondiale.
Le microbiote intestinal Schizophrénie La transplantation fécale
 Une gélule high-tech pour prélever le microbiote intestinal
Une gélule high-tech pour prélever le microbiote intestinal
Maladie de Crohn : une dysbiose intestinale précèderait la crise
Les crises inflammatoires de la maladie de Crohn seraient précédées d’un déséquilibre du microbiote. Ainsi, bien que les patients ne ressentent aucun symptôme précurseur, certains taxons bactériens se réduiraient au profit d’autres. De quoi prédire les futures crises ?
Le microbiote intestinal Maladie de Crohn infantile : dysbiose confirmée Crohn : Le microbiote intestinal prédictif des récidives ?
Le microbiote intestinal influencerait-il notre glycémie ?
La variation de la glycémie après un repas est propre à chacun et dépend en grande partie de caractéristiques individuelles. Parmi elles, la composition du microbiote intestinal compterait très probablement, selon une nouvelle étude qui confirme l’intérêt de développer des approches personnalisées pour prévenir le diabète.
Le microbiote intestinal Le syndrome métabolique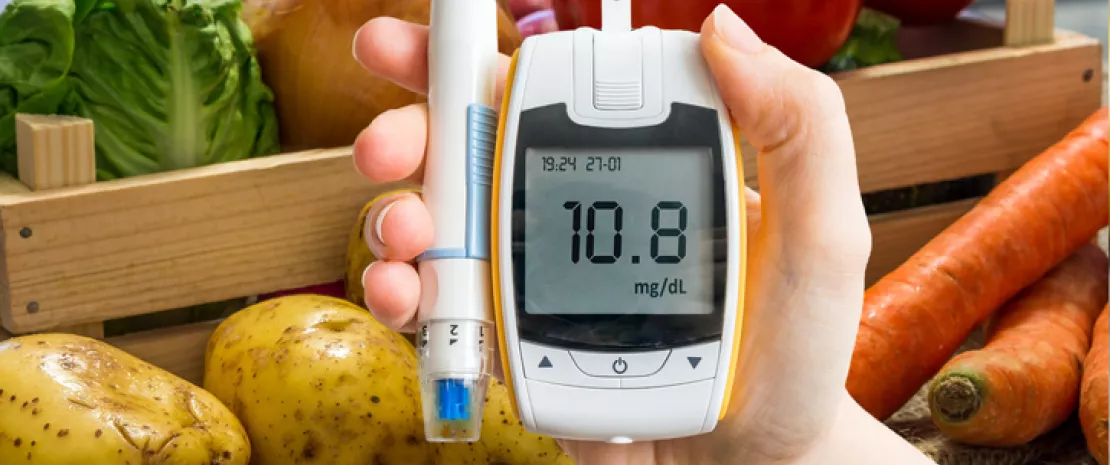
Sources :
H Mendes-Soares, T Raveh-Sadka, S Azulay et al. Assessment of a Personalized Approach to Predicting Postprandial Glycemic Responses to Food Among Individuals Without Diabetes. JAMA Network Open. 2019;2(2):e188102.
La transplantation fécale, solution à l’antibiorésistance chez les patients immunodéprimés ?
Pour lutter contre les infections à bactéries multi-résistantes, la transplantation de microbiote fécal confirme non seulement son efficacité mais également sa sûreté, y compris chez des patients immunodéprimés, révèle une étude franco-italienne.
Le microbiote intestinal Antibiotiques et microbiote intestinal : quels impacts sur le long terme ? Exposition aux antibiotiques de 0 a 6 ans : un microbiote intestinal perturbe, un developpement de l’enfant altere Maladie de parkinson : les antibiotiques, et le microbiote, impliqués
 Exposition aux antibiotiques de 0 a 6 ans : un microbiote intestinal perturbe, un developpement de l’enfant altere
Exposition aux antibiotiques de 0 a 6 ans : un microbiote intestinal perturbe, un developpement de l’enfant altere
Microplastiques : un régal pour les bactéries !
Des bactéries toxiques, qui colonisent les microparticules de plastique polluant les eaux terrestres – a fortiori dans les zones à forte activité humaine et à fort trafic maritime –, seraient capables de blanchir les massifs coralliens et de provoquer des infections chez l’homme.
L'alimentation
 Montre-moi ta flore intestinale, et je te dirai d’où tu viens
Montre-moi ta flore intestinale, et je te dirai d’où tu viens
 MICROREVEAL #2 : zoom sur le microbiote intestinal
MICROREVEAL #2 : zoom sur le microbiote intestinal
Sources :
E Curren, S Chee, Y Leong. Profiles of bacterial assemblages from microplastics of tropical coastal environments. Science of the Total Environment 2019 Mar 10;655:313-320.
Anévrisme intracrânien : le microbiote intestinal au cœur du risque ?
Des expériences précliniques semblent montrer que le microbiote intestinal serait capable d’affecter directement la physiopathologie des anévrismes intracrâniens. Comment ? En modulant l’inflammation.
Le microbiote intestinal Un indice de dysbiose intestinale pour préciser le pronostic post-avc Rôle du microbiote dans la communication intestin cerveau Maladie de parkinson : les antibiotiques, et le microbiote, impliqués
Ruminococcus gnavus, le grand méchant loup du lupus ?
On suspectait que le microbiote soit impliqué dans le lupus (dit « érythémateux disséminé », sa forme la plus courante), une maladie chronique auto-immune rare et difficile à diagnostiquer. Grâce aux récents travaux d’une équipe américaine, une bactérie spécifique est désormais pointée du doigt : Ruminococcus gnavus.
Le microbiote intestinal Lupus - une maladie auto-immune
Sources :
Azzouz D, Omarbekova A, Heguy A et al. Lupus nephritis is linked to disease-activity associated expansions and immunity to a gut commensal. Ann Rheum Dis 2019.
Le microbiote de la langue, biomarqueur du cancer pancréatique ?
La présence d’un cancer du pancréas modifierait la composition bactérienne du microbiote de la langue. Une dysbiose caractéristique, qui pourrait conduire au développement d’outils diagnostiques.
Le microbiote intestinal Cancer du pancreas : le liquide duodenal, un miroir du risque ? Cancer du pancréas : le rôle majeur des bactéries de la tumeur Antibiotiques et microbiote intestinal : quels impacts sur le long terme ?







