Biegunka poantybiotykowa
Antybiotyki to potężna broń w walce z zakażeniami bakteryjnymi. Niekiedy wydaje się, że leczenie nimi nie pociąga za sobą na krótką metę widocznych skutków ubocznych, ale zaburzenie równowagi mikrobioty jelit, które jest jego następstwem, wywołuje biegunkę aż u 35% pacjentów.1-3 Za tą poantybiotykową biegunką może czasem się kryć poważna infekcja jelit.3
- Dowiedz się wszystkiego o mikrobiocie
- Mikrobiota i powiązane z nią zaburzenia
- Zadbaj o swoją mikrobiotę
- Publikacje
- O Instytucie
Dostęp do pracowników służby zdrowia
Znajdź tutaj swoją dedykowaną przestrzeń
en_sources_title
en_sources_text_start en_sources_text_end
Sekcje
O tym artykule
W jaki sposób antybiotyki zaburzają równowagę flory jelit?
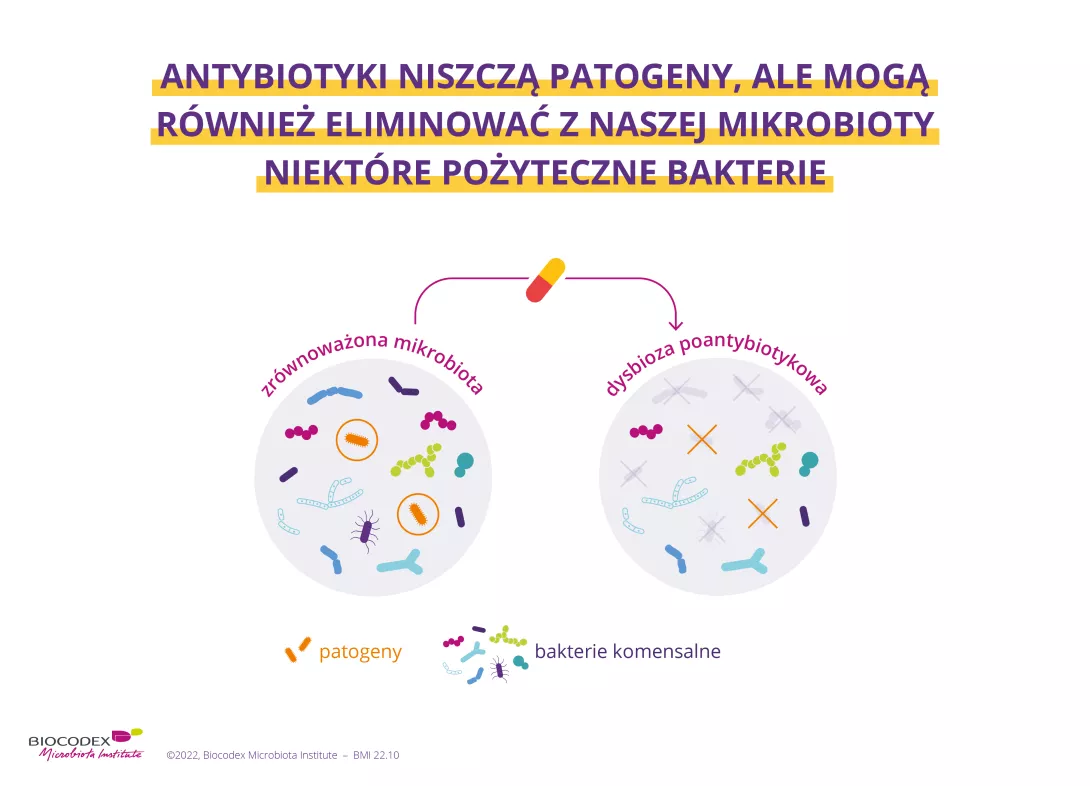
Antybiotyki zwalczają (sidenote: Patogen To mikroorganizm, który powoduje lub może spowodować chorobę Pirofski LA, Casadevall A. Q and A: What is a pathogen? A question that begs the point. BMC Biol. 2012 Jan 31;10:6. ) odpowiedzialne za infekcję, ale mogą również niszczyć niektóre pożyteczne bakterie stanowiące element Twojej mikrobioty, powodując większe albo mniejsze zaburzenia równowagi tego ekosystemu. Zjawisko to, znane pod nazwą (sidenote: Dysbioza Dysbioza nie jest zjawiskiem jednorodnym; przybiera różne formy zależne od stanu zdrowia danej osoby. Zazwyczaj definiuje się ją jako zaburzenie składu i funkcjonowania mikrobioty spowodowane przez zestaw czynników środowiskowych i osobniczych zakłócających ekosystem mikroorganizmów. Levy M, Kolodziejczyk AA, Thaiss CA, et al. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17(4):219-232. ) , daje początek biegunce poantybiotykowej, ponieważ mikrobiota jelit jest wtedy w mniejszym stopniu zdolna do pełnienia swoich funkcji ochronnych. Problem ten może dotyczyć nawet 35% pacjentów,1-3 a w przypadku dzieci odsetek ten może sięgać nawet 80%.1

Co więcej, mikrobiota jelit – mimo że jest do pewnego stopnia elastyczna (to znaczy, że wraca do składu podobnego do tego, który ją charakteryzował przed rozregulowaniem przez antybiotyki) – czasem może nie zostać całkowicie odtworzona.4,5 Niedawne badania wykazały, że antybiotyki mogą zaburzyć zróżnicowanie i obfitość bakterii, a nierównowaga ta może trwać długo (zazwyczaj od 8 do 12 tygodni po zakończeniu leczenia).1,6
W większości przypadków biegunka przebiega bez innych objawów
W krótkim terminie główną konsekwencją terapii antybiotykowej jest zmiana tranzytu jelitowego u niektórych pacjentów najczęściej przejawiająca się biegunką. Termin ten oznacza co najmniej trzy bardzo miękkie lub płynne wypróżnienia w ciągu 24 godzin po rozpoczęciu terapii antybiotykowej lub w okresie 2 miesięcy po jej zakończeniu.7-9 Częstotliwość występowania biegunki zależy od kilku czynników (wieku, sytuacji, rodzaju antybiotyku itp). W większości przypadków jej przyczyny mają charakter funkcjonalny, to znaczy są związane z zaburzeniem równowagi mikrobioty jelit. Nasilenie biegunki waha się od lekkiego do umiarkowanego.1 Antybiotyki o szerszym spektrum działania antymikrobowego (czyli działające na bardzo wiele bakterii) mają związek z częstszym występowaniem biegunki.3
Antybiotyki ratują życie! Czy wiesz, że mają też wpływ na mikroflorę jelitową? Czy wiesz, że niewłaściwe stosowanie i nadużywanie antybiotyków może prowadzić do oporności na te leki? Czy słyszałeś(-aś) o Światowym Tygodniu Wiedzy o Antybiotykach (WAAW)? Wszystkie odpowiedzi przedstawiono na tej dedykowanej stronie :
Antybiotyki: jaki wpływ na mikrobiotę i nasze zdrowie?
Jednak w 10–20% przypadków biegunka jest wynikiem zakażenia Clostridioides difficile (C. difficile) – bakterią, która może stać się patogenem pod wpływem pewnych czynników – takich jak przyjmowanie antybiotyków, a także wiek powyżej 65 lat albo niektóre choroby towarzyszące.3 Kolonizacja mikrobioty jelit przez tę bakterię powoduje reakcję zapalną, której efekty kliniczne obejmują zakres od umiarkowanej biegunki po dużo poważniejsze objawy, a nawet śmierć.3
Odstawienie antybiotyków – czy to najskuteczniejsza terapia?
Postępowanie w przypadku biegunki poantybiotykowej zależy od objawów i czynnika chorobotwórczego (może nim być na przykład C. difficile).10 W przypadku biegunki od lekkiej do umiarkowanej leczenie polega na odstawieniu antybiotyku (lub zastąpieniu go antybiotykiem o mniejszym ryzyku wystąpienia biegunki) w celu umożliwienia odtworzenia mikrobioty i nawodnienia organizmu pacjenta.10
Liczne badania wykazały skuteczność probiotyków w odtwarzaniu mikrobioty jelit. Wykazano skuteczność niektórych probiotyków w zapobieganiu i leczeniu biegunki poantybiotykowej.6,11,12 Inne badania wykazały, że ich przyjmowanie w trakcie terapii antybiotykowej zmniejsza ryzyko pierwotnej infekcji C. difficile oraz infekcji nawracających.13-15 Transplantacja mikrobioty fekalnej polegająca na wprowadzeniu naturalną drogą zdrowej mikrobioty do organizmu chorej osoby w celu odtworzenia jej ekosystemu mikrobowego jest na razie ograniczona do przypadków najcięższych infekcji; jest wskazana tylko w leczeniu nawrotów infekcji chorobotwórczą bakterią C. difficile.16,17
Niniejszy artykuł jest oparty na potwierdzonych źródłach naukowych, ale nie zastępuje porady lekarza. W przypadku wystąpienia objawów należy zasięgnąć porady lekarza rodzinnego lub pediatry.
Co to jest Światowy Tydzień Wiedzy o Antybiotykach?
Każdego roku od 2015 r. WHO organizuje Światowy Tydzień Wiedzy o Antybiotykach (WAAW, ang. World Antibiotic Awareness Week), którego celem jest zwiększanie świadomości dotyczącej globalnej oporności na leki przeciwdrobnoustrojowe.
Oporność na środki przeciwdrobnoustrojowe występuje, gdy bakterie, wirusy, pasożyty i grzyby zmieniają się na przestrzeni czasu i nie odpowiadają już na leki. W rezultacie lekooporności antybiotyki i inne leki przeciwdrobnoustrojowe stają się nieskuteczne, a wyleczenie zakażeń jest coraz trudniejsze lub niemożliwe, co zwiększa ryzyko rozprzestrzeniania się chorób, ich ciężkiego przebiegu oraz zgonu.
Niniejsza kampania, obchodzona w dniach 18–24 listopada, zachęca całe społeczeństwo, fachowy personel medyczny oraz decydentów do ostrożnego stosowania antybiotyków, leków przeciwwirusowych, przeciwgrzybiczych i przeciwpasożytniczych, aby zapobiec dalszemu wyłanianiu się oporności mikroorganizmów.
1 McFarland LV, Ozen M, Dinleyici EC et al. Comparison of pediatric and adult antibiotic-associated diarrhea and Clostridium difficile infections. World J Gastroenterol. 2016;22(11):3078-3104.
2 Bartlett JG. Clinical practice. Antibiotic-associated diarrhea. N Engl J Med 2002;346:334-9.
3 Theriot CM, Young VB. Interactions Between the Gastrointestinal Microbiome and Clostridium difficile. Annu Rev Microbiol. 2015;69:445-461.
4 Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci U S A. 2011;108 Suppl 1(Suppl 1):4554-4561.
5 Francino MP. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol. 2016;6:1543.
6 Kabbani TA, Pallav K, Dowd SE et al. Prospective randomized controlled study on the effects of Saccharomyces boulardii CNCM I-745 and amoxicillin-clavulanate or the combination on the gut microbiota of healthy volunteers. Gut Microbes. 2017;8(1):17-32.
7 Wiström J, Norrby SR, Myhre EB, et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J Antimicrob Chemother. 2001 Jan;47(1):43-50.
8 McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea. Dig Dis. 1998 Sep-Oct;16(5):292-307.
9 Bartlett JG, Chang TW, Gurwith M, et al. Antibiotic-associated pseudomembranous colitis due to toxin-producing clostridia. N Engl J Med. 1978 Mar 9;298(10):531-4.
10 Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ. 2002 Jun 8;324(7350):1345-6.
11 Szajewska H, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther. 2015 Oct;42(7):793-801.
12 Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012 May 9;307(18):1959-69.
13 McFarland LV, Surawicz CM, Greenberg RN, et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease. JAMA. 1994 Jun 22-29;271(24):1913-8.
14 Kotowska M, Albrecht P, Szajewska H. Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea in children: a randomized double-blind placebo-controlled trial. Aliment Pharmacol Ther. 2005 Mar 1;21(5):583-90.
15 McFarland LV. Probiotics for the Primary and Secondary Prevention of C. difficile Infections: A Meta-analysis and Systematic Review. Antibiotics (Basel). 2015 Apr 13;4(2):160-78.
16 Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013 Apr;108(4):478-98; quiz 499.
17 Li YT, Cai HF, Wang ZH, et al. Systematic review with meta-analysis: long-term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther. 2016 Feb;43(4):445-57.














