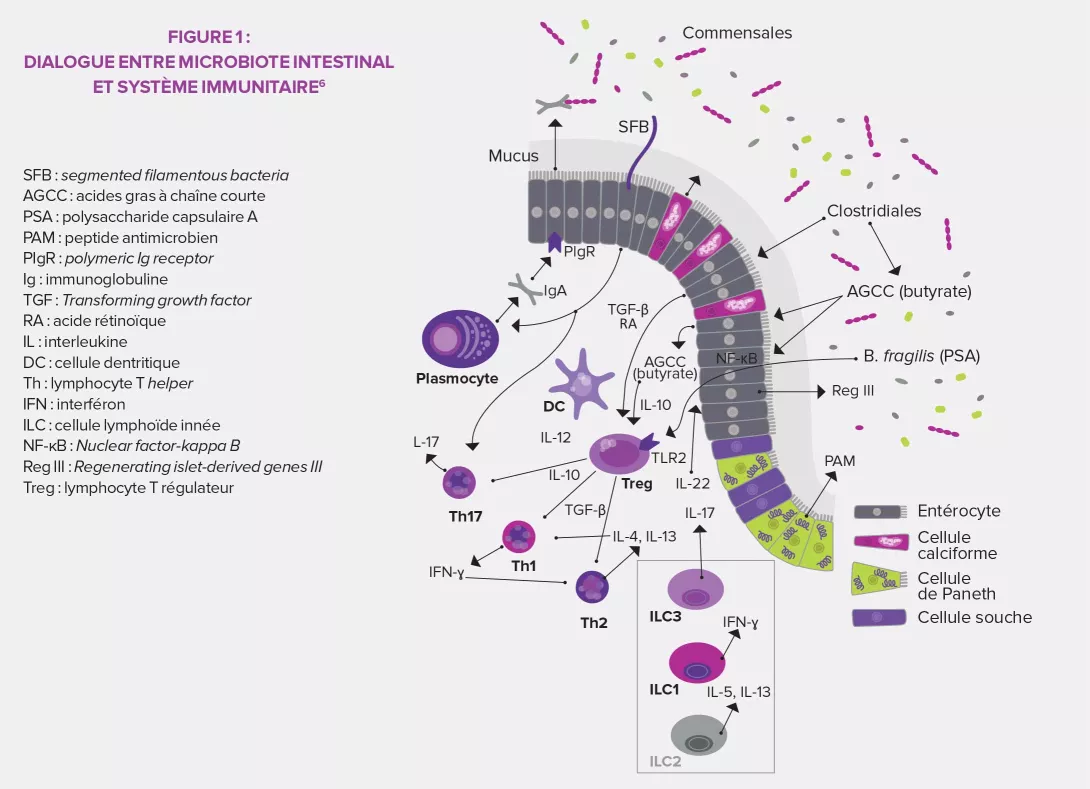
Bien que limitée chez les patients immunodéprimés en raison d’un risque infectieux majoré, l’utilisation de prébiotiques ou de probiotiques et la transplantation de microbiote fécal (TMF) peuvent apporter des bénéfices notables pour des patients ayant reçu une greffe de CSH. Combinée à de nouvelles techniques d’analyse, de caractérisation et de suivi du microbiote intestinal, la prévention des infections et des rejets de greffons pourrait s’en trouver transformée.
Dans une étude réalisée chez 30 enfants et adolescents, l'emploi de probiotiques, en particulier une espèce de Lactobacillus, pendant la prophylaxie antibiotique et en post-greffe de CSH a permis d’éviter la survenue de GVHD dans 70 % des cas, sans bactériémie à Lactobacillus subséquente13. Concernant la TMF, son innocuité et son action bénéfique face à une infection à C. difficile ont récemment été démontrées sur de petites cohortes de patients receveurs d'une greffe de CSH13 : la transplantation fécale a permis une rémission dans 3 cas sur 4 dans l'un des essais, et dans une autre étude une diminution des symptômes lors du rejet du greffon contre l'hôte (GVHD) après plusieurs greffes. Une transplantation fécale autologue post-antibiothérapie permet une restauration du microbiote intestinal originel à J+100 après greffe de CSH16. Certains scientifiques proposent ainsi de réaliser une TMF avant une greffe de CSH chez des patients porteurs de souches résistantes de C. difficile.
ALIMENTATION ET PRÉBIOTIQUES
Les acides gras à chaîne courte (notamment le butyrate) ont montré des effets positifs contre la GVHD. Source d'énergie mais aussi agents anti-apoptotiques des entérocytes, ils exercent une action anti-inflammatoire en promouvant la synthèse de Treg. Des effets bénéfiques sur la muqueuse intestinale ont été observés avec d'autres éléments métabolisés par le microbiote digestif : les dérivés indolés issus de la fermentation des Brassicaceae (choux, brocolis…), le tryptophane (produits laitiers, banane17…), les acides biliaires. L'association de fibres, glutamine et oligosaccharides – a permis de réduire la morbi-mortalité chez 44 patients greffés. Un essai est également en cours concernant les bénéfices de l'amidon résistant, prébiotique favorisant la production de butyrate12.
D'AUTRES INNOVATIONS EN DÉVELOPPEMENT
L’arsenal thérapeutique pourrait en outre s’enrichir d'innovations telles que l’antibiothérapie ciblée visant à limiter la destruction de la barrière digestive et à limiter l’émergence de bactéries multirésistantes (sont à l’essai des antibiotiques guidés par des anticorps spécifiques d’un pathogène, ou des bactéries synthétiques compétitrices de pathogènes). De nouvelles technologies permettent de recréer in vitro des interactions se déroulant in vivo au sein du microbiote gastro-intestinal. Les outils de profilage bactérien ouvrent quant à eux la voie à une médecine personnalisée, adaptée au microbiote de chaque patient afin de décider du meilleur protocole thérapeutique à suivre12.