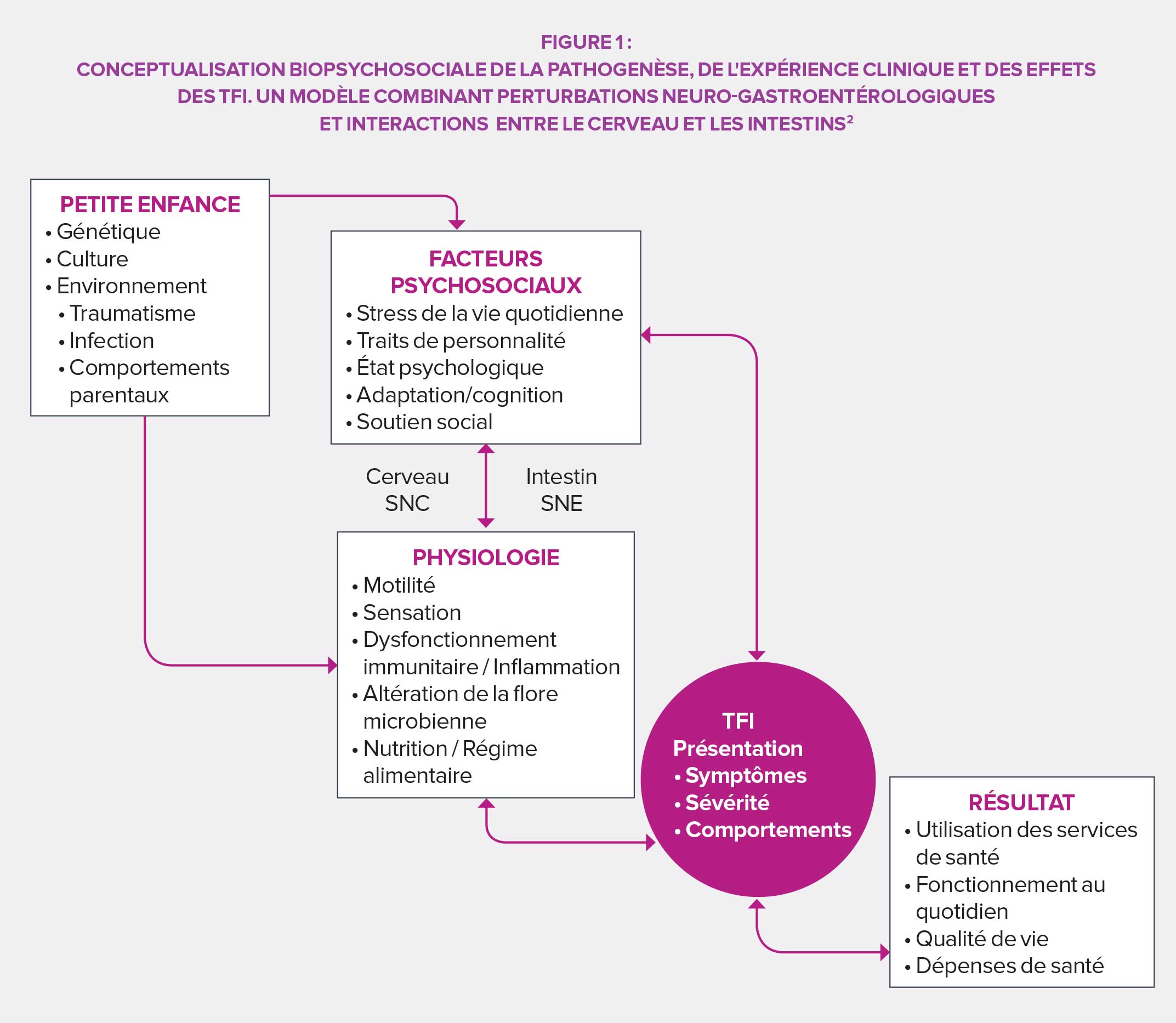
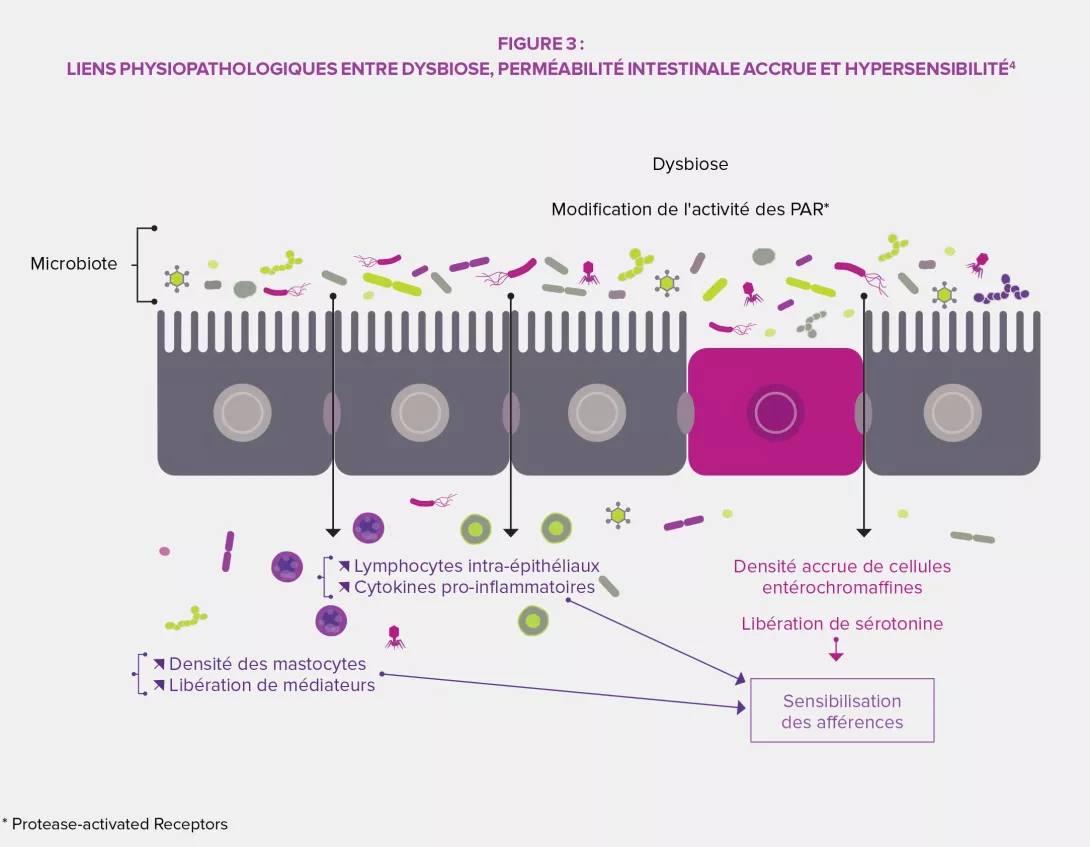
PHYSIOPATHOLOGIE DES DOULEURS ABDOMINALES FONCTIONNELLES11
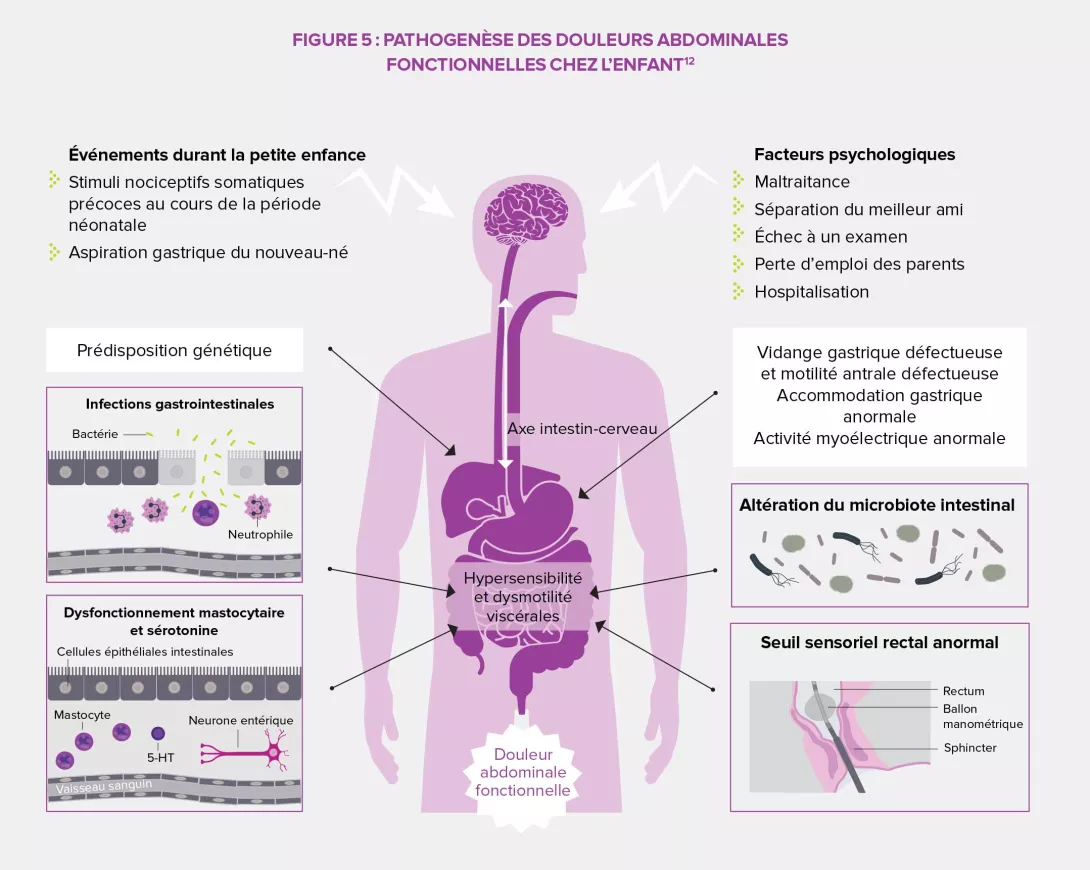
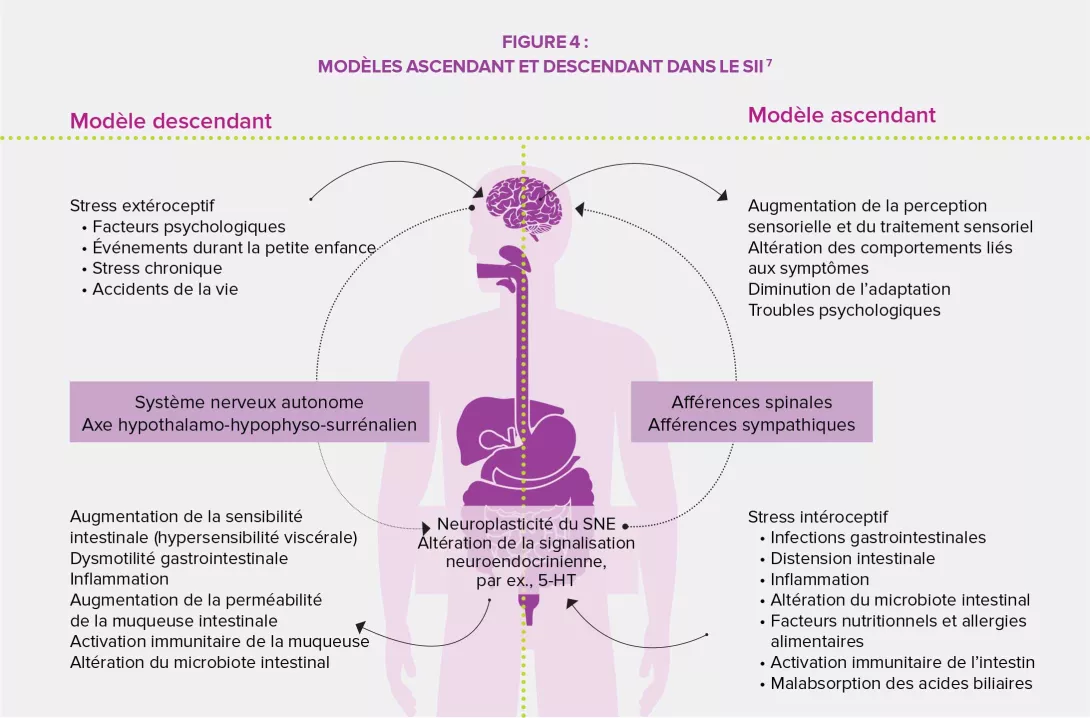
Les douleurs abdominales fonctionnelles sont l’un des syndromes les plus fréquents chez l’enfant, avec une prévalence mondiale estimée à 13,5 % en 2014. La majorité des étiologies sont fonctionnelles et impliquent des changements dans les sensations viscérales (hyperalgie) et une motilité gastro-intestinale altérée. Les premières se traduisent par de l’inconfort et des douleurs, les secondes par de la diarrhée ou de la constipation, des nausées, des ballonnements, des distensions…La diversité de symptômes observés a mené la Rome Foundation à distinguer quatre grandes catégories de douleurs abdominales fonctionnelles chez l’enfant : le syndrome de l’intestin irritable, la dyspepsie fonctionnelle, la migraine abdominale et les douleurs fonctionnelles abdominales n’entrant pas dans un des champs précédents.
SII : UNE PERCEPTION CULTURELLE ?
TFI le plus fréquent chez l’enfant et véritable enjeu de santé publique au niveau mondial, le syndrome de l’intestin irritable n’en reste pas moins méconnu. De fait, sa seule perception semble varier significativement selon les pays et les études, puisque les prévalences varient de 5,1 % aux États-Unis à 22,6 % en Turquie en passant par une fourchette comprise entre 2,8 % et 25,7 % dans certains pays d’Asie. Des différences potentiellement imputables à des particularismes locaux, mais plus probablement à des interprétations variables des critères diagnostiques de Rome IV en fonction des cultures, du rapport à la douleur et à ce qui est considéré comme une pathologie véritable – et non une simple modification du transit intestinal.
SII PÉDIATRIQUE : UNE PRISE EN CHARGE HOLISTIQUE
Caractérisé par une moindre diversité du microbiote digestif (notamment au contact de la muqueuse), une augmentation de certaines Clostridies et Firmicutes (Veillonella) et une diminution des bifidobactéries (Tableau 1), le SII représente 40 à 45 % des TFI chez l’enfant. Dans son traitement, l’éducation thérapeutique des parents occupe une place centrale, leur anxiété pouvant avoir un impact important sur la sévérité des symptômes comme sur l’efficacité du traitement, qu’il soit pharmacologique ou non. Les médicaments usuels sont ceux du SII de l’adulte : stimulateurs de motilité intestinale, antispasmodiques, anti-acides, anti-histaminiques, anti-reflux… dont l’efficacité n’a pas été évaluée. Parmi les traitements non pharmacologiques, une revue de la littérature suggère que certaines approches psychologiques (imagerie mentale, hypnose, thérapie cognitivo-comportementale, pratique du yoga) pourraient participer à un mieux-être de l’enfant. Compte tenu des perturbations du microbiote identifiées chez les jeunes patients atteints de SII, utiliser des probiotiques est également une option thérapeutique prometteuse.
PRÉDISPOSITION ET PRÉVENTION
Il existe une multitude de facteurs de prédisposition au SII : sexe, âge, facteurs psychologiques, traumatismes néonataux, infections gastro-intestinales, asthme et affections atopiques, régime alimentaire, facteurs socio-économiques, familiaux et environnementaux… Quelques-uns peuvent constituer des axes potentiels pour la mise en place d’actions préventives qui viseraient à réduire la prévalence des troubles chez les enfants et les adultes fragilisés durant leur enfance, de même que les coûts de santé à l’échelle individuelle et sociétale. Charge aux différents systèmes sanitaires de prioriser leurs orientations et leurs actions en fonction des risques, des besoins et des possibilités.