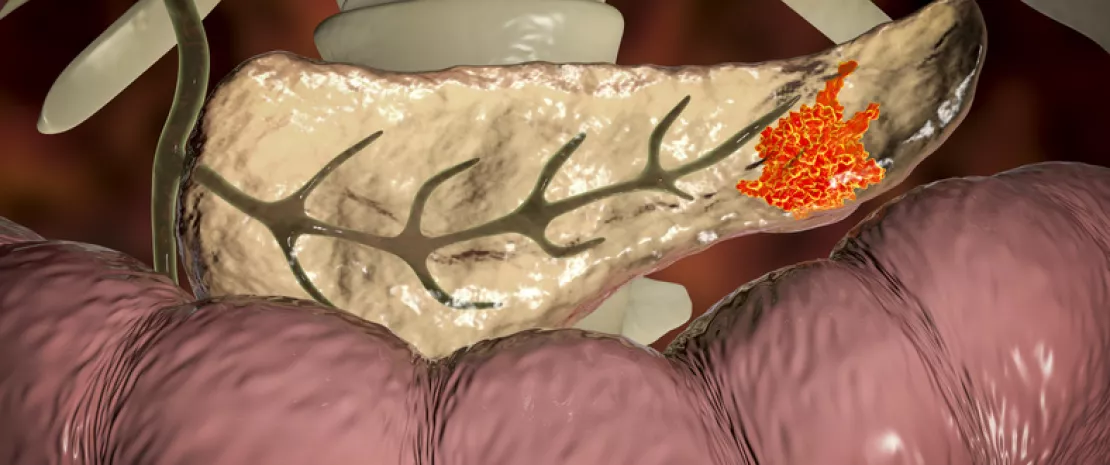
L’adénocarcinome canalaire pancréatique (PDAC, pour pancreatic ductal adenocarcinoma) est un cancer redouté : généralement détecté tardivement, son pronostic est sombre, avec une survie globale à 5 ans de 9 %. Une survie dans laquelle le microbiote tumoral jouerait un rôle, au regard des foisonnants résultats publiés dans Cell par 31 chercheurs, majoritairement américains.
Plus de diversité, plus de survie
Pour comprendre le rôle du microbiote tumoral et du système immunitaire sur la survie à long terme, ces chercheurs ont analysé la composition du microbiote de tumeurs réséquées chez 68 patients PDAC divisés en deux groupes : 36 patients ayant survécu plus de 5 ans (en moyenne 10,1 ans) et 32 malades décédés moins de 5 ans après l’intervention (en moyenne après 1,6 an). Leurs résultats mettent en avant une plus grande diversité des espèces bactériennes présentes dans le microbiote tumoral des patients ayant survécu plus de 5 ans. Des résultats que les chercheurs ont validé auprès d’une deuxième cohorte.
Une modulation immunitaire
Par ailleurs, les auteurs ont mis en évidence que les deux groupes de patients présentent chacun une signature du microbiote intra-tumoral spécifique : la présence et l'abondance de 3 genres bactériens (Pseudoxanthomonas, Streptomyces, Saccharopolyspora) et de Bacillus clausii permettent de prédire la survie dans 97,51 à 99,17 % des cas (selon la cohorte). Des analyses immuno-histologiques complémentaires laissent entrevoir que la composition du microbiote tumoral pourrait influencer la progression du cancer en modulant la réponse immunitaire anti-tumorale via le recrutement et l’activation de lymphocytes T CD8.
De l’intestin à la tumeur
En parallèle, l’analyse des selles, des tissus tumoraux réséqués et des tissus non-cancéreux adjacents de trois patients a montré que le microbiote intestinal représente environ 25 % du microbiote tumoral, alors qu’il est absent des tissus adjacents : le microbiote tumoral pourrait donc être colonisé par le microbiote intestinal. Enfin, des transplantations de microbiote fécal (TMF) issus de trois types de patients (survie longue, courte ou témoin) ont été réalisées chez des souris. Ces travaux ont confirmé la capacité du microbiote intestinal à coloniser les tumeurs pancréatiques. Ils suggèrent par ailleurs sa capacité à modifier la composition bactérienne de la tumeur et à moduler ainsi la fonction immunitaire, affectant in fine la trajectoire du cancer et la survie du patient. Outre la possibilité d’un pronostic reposant sur le microbiote tumoral, les résultats des TMF laissent espérer de pouvoir un jour manipuler ce microbiote afin d’améliorer l’espérance de vie des patients PDAC, pour lesquels peu d'options thérapeutiques existent à l’heure actuelle.