On le sait : une moindre diversité de micro-organismes dans le microbiote intestinal est associée à des pathologies comme le diabète, le cancer colorectal et les troubles gastro-intestinaux complexes comme les MICI. Mais pour utiliser cette diversité comme biomarqueur, encore faut-il en avoir une bonne image : alors que les métabolites fécaux sont un indicateur de la composition du microbiote, qu’en est-il des métabolites sanguins ?
40 métabolites prédictifs identifiés
Pour le savoir, une équipe a tenté de prédire la diversité du microbiote intestinal à partir de quelque 1 000 analytes sanguins dans une cohorte de 399 adultes américains en bonne santé participant à un programme sur le bien-être. Les résultats montrent que 40 métabolites présents dans le sang de l’hôte, dont 13 d’origine microbienne, expliquent 45 % de la diversité du microbiote intestinal, qu’ils pourraient donc prédire. Cette capacité de prédiction des métabolites a été confirmée dans une cohorte de validation distincte portant sur 540 personnes, en plus ou moins bonne santé.
Ni trop, ni trop peu de diversité
Par ailleurs, les résultats suggèrent que plus qu’une diversité maximale, c’est une diversité optimale qu’il conviendrait de privilégier pour une bonne santé. Car d’une part, on observe une association positive entre des métabolites microbiens polyphénoliques et la diversité du microbiote intestinal, qui pourrait refléter un régime alimentaire riche en fruits, légumes et céréales (eux-mêmes riches en polyphénols). Mais d’autre part, certains des métabolites microbiens prédictifs de diversité sont liés à des pathologies cardiovasculaires ou rénales. Ainsi, de même qu’un manque de diversité, un excès pourrait se révéler délétère. Au point que les auteurs évoquent l’idée d’un intervalle idéal caractérisé par « ni trop, ni trop peu » de diversité en fonction de la valeur de l’indice. Enfin, les auteurs relèvent que les associations entre les métabolites sanguins et la diversité du microbiote intestinal diffèrent tout au long des classes d’indice de masse corporelle (IMC), suggérant qu’il est trop restrictif de se limiter aux seules catégories d’IMC « normal » et « obèse ».
Vers des tests cliniques ?
Pris globalement, ces résultats témoignent de l'intime relation entre la physiologie de l'hôte et le microbiote intestinal, et suggèrent que le métabolome sanguin de l’hôte constitue une interface importante entre l’écosystème intestinal et la santé humaine. À terme, la capacité de marqueurs plasmatiques à prédire la diversité du microbiote intestinal pourrait ouvrir la voie à la mise au point de tests cliniques permettant de surveiller la santé microbienne intestinale par simple prélèvement sanguin, facile à analyser.

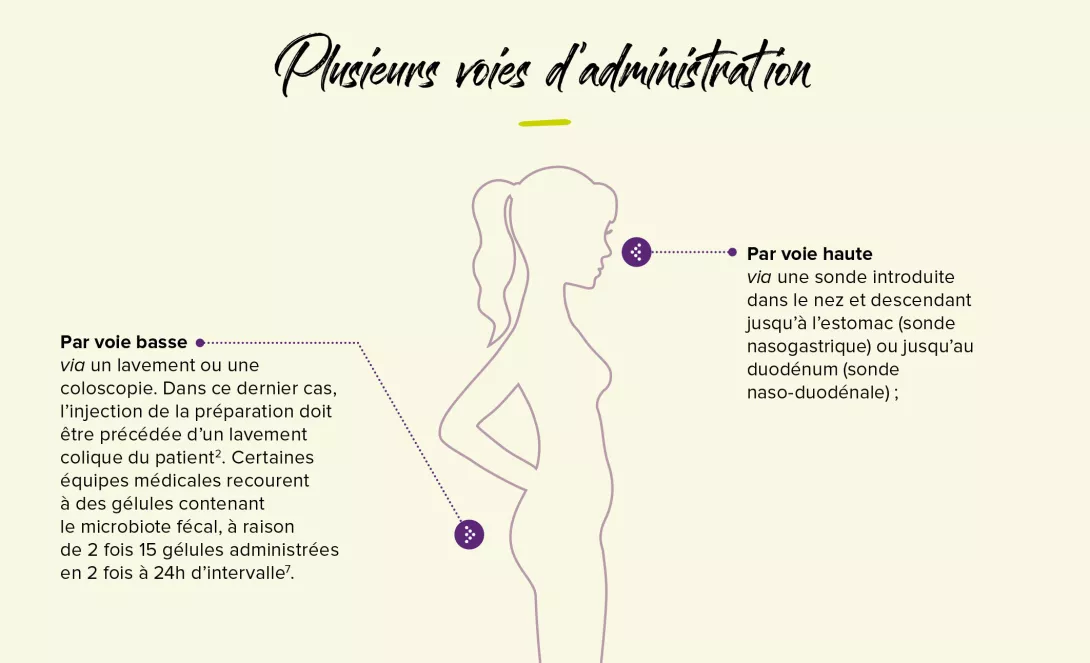
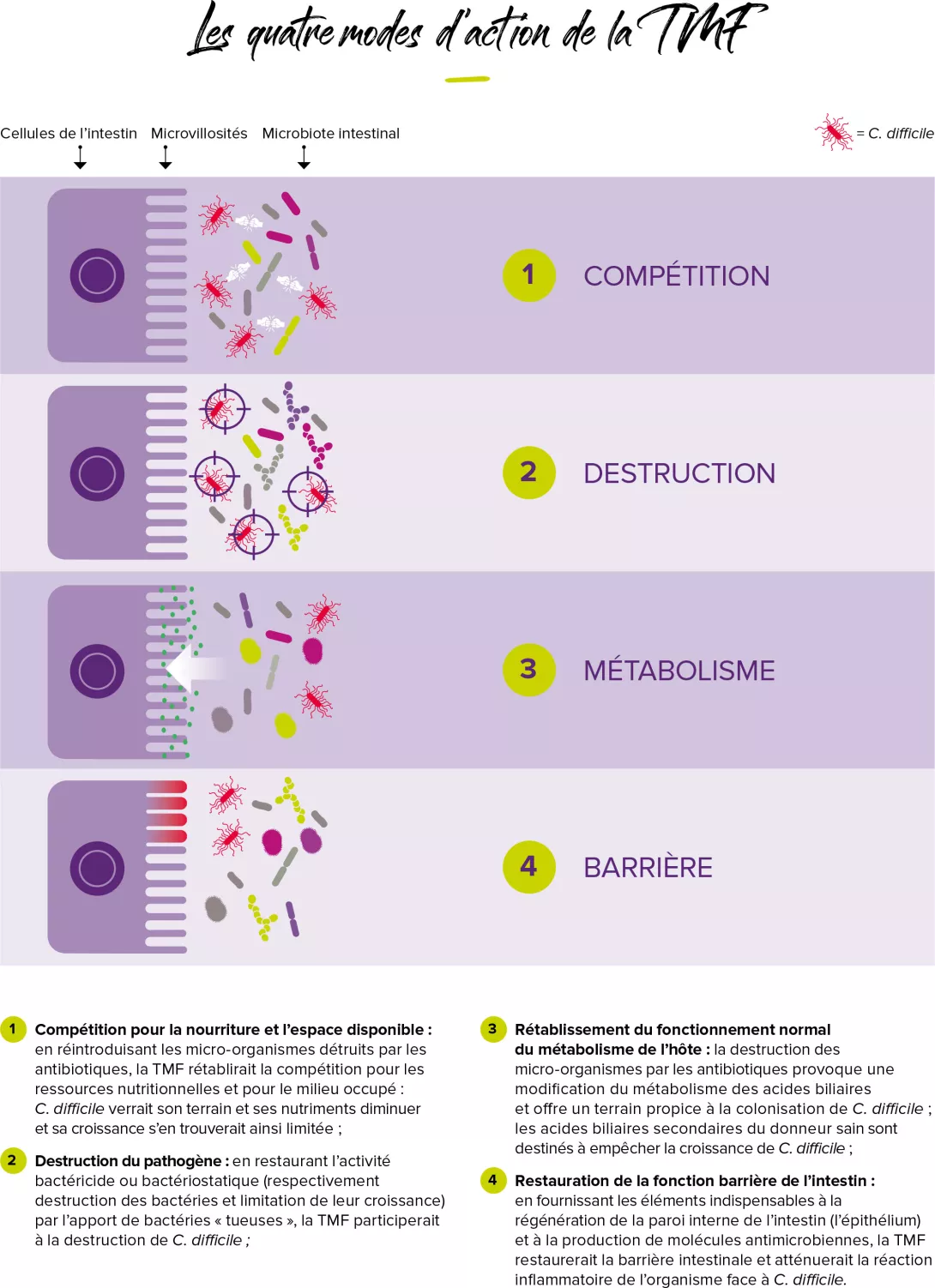
 La greffe fécale, une piste prometteuse ?
La greffe fécale, une piste prometteuse ?