EXPOSICIÓN A ANTIBIÓTICOS Y EII CRÓNICA TEMPRANA
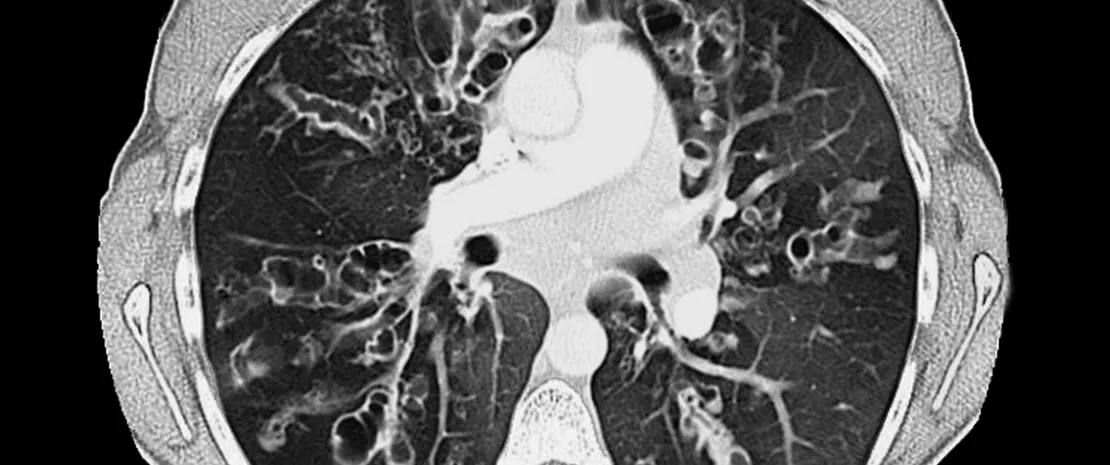
El caso del sobrepeso pone de manifiesto la complejidad de las repercusiones de las disbiosis en ciertas áreas de la medicina. Las relaciones causales están mejor documentadas en gastroenterología, donde se ha demostrado de forma inequívoca el vínculo entre la microbiota intestinal y las enfermedades inflamatorias intestinales (EII) crónicas. Dicha relación ha incitado a un creciente número de investigadores a tener en cuenta las disbiosis al investigar trastornos mal comprendidos, en particular la colitis ulcerosa (UC) y la enfermedad de Crohn en niños menores de 6 años, ya que su incidencia está aumentando constantemente a escala mundial. Dado que esta progresión no puede atribuirse a factores genéticos y ambientales conocidos, podría deberse a una fragilización del intestino causada por alteraciones de la microbiota
EL RIESGO DE EII CRÓNICA SE DUPLICA DESPUÉS DE UN TRATAMIENTO CON ANTIBIÓTICOS DURANTE EL PARTO
Un equipo de investigadores suecos3 decidió explorar esta hipótesis estudiando una cohorte de 827 239 niños nacidos entre 2006 y 2013. Este análisis a gran escala se basó en un análisis comparativo de los registros nacionales suecos de nacimientos, pacientes y prescripciones de medicamentos. En total, el 17% de los sujetos fueron expuestos a antibióticos durante el parto (el 5% de ellos en varias ocasiones) y el 65% después del nacimiento, en la mayoría de los casos más de una vez (7 de cada 10). Por otra parte, 51 niños presentaron enfermedad de Crohn o colitis ulcerosa. En comparación con la población de control, el riesgo de desarrollar una EII crónica temprana fue mayor (aHR4 = 1,93) en los niños expuestos a antibióticos durante el embarazo.
EFECTOS EN EL FETO
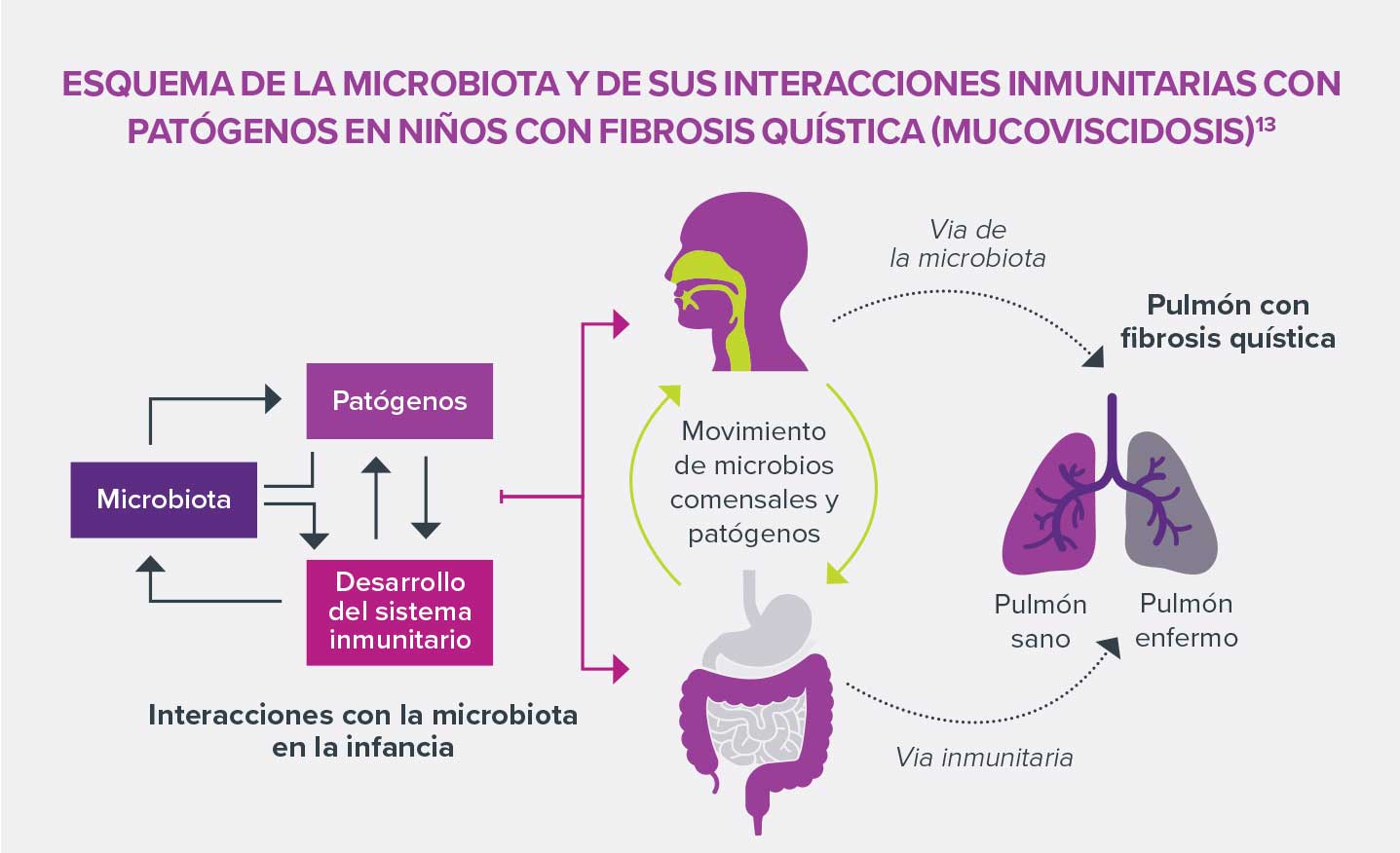
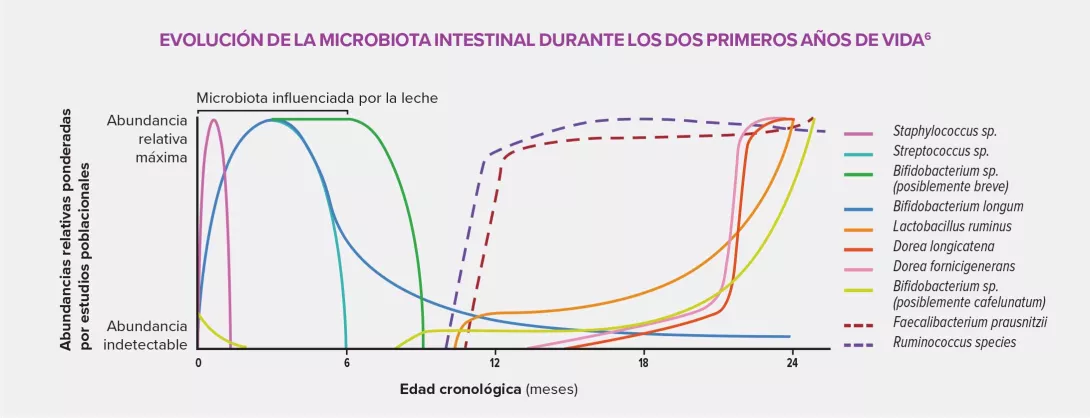
La exposición intrauterina a antibióticos podría provocar una alteración de la colonización bacteriana temprana del niño, caracterizada por una baja concentración de bacterias comensales, en particular Faecalibacterium prausnitzii y Ruminococcaceae, así como por un aumento de bacterias patógenas. Esta disbiosis podría dar lugar a importantes modificaciones fisiológicas por las interacciones que tienen lugar entre la microbiota y el huésped y que consisten en la producción de AGCC5 (sobre todo butirato), la inducción del sistema inmunitario de la mucosa intestinal, la estimulación del sistema nervioso local y el mantenimiento de la función de «barrera» del intestino.Todas estas alteraciones pueden causar trastornos inflamatorios.
MEJORAR LAS PRÁCTICAS DE PRESCRIPCIÓN DE ANTIBIÓTICOS PARA PRESERVAR LA MICROBIOTA
Los datos presentados aquí y los resultados de un creciente número de estudios y publicaciones demuestran que una microbiota diversificada, con una proporción elevada de bacterias comensales con respecto a bacterias patógenas, participa en el desarrollo adecuado del niño limitando la aparición de algunas enfermedades,sobre todo de tipo metabólico o inflamatorio. Esta observación no debe conducir a un rechazo generalizado del tratamiento antibiótico cuya eficacia y beneficios son imprescindibles en numerosos casos, como resaltan todos los profesionales sanitarios. En cambio, la optimización de las prescripciones, del espectro de acción de las sustancias activas empleadas, de la duración del tratamiento y de las formas de administración permitiría reducir los efectos nocivos de los antibióticos y la transferencia de resistencia a la microbiota intestinal, preservando la salud del niño a corto y largo plazo.