UN CAMBIO DE PERSPECTIVA
Los trastornos funcionales intestinales, percibidos como vergonzosos en numerosas culturas, se consideraron durante mucho tiempo como parte de la vida privada y relacionados con el estrés y las emociones más que como un trastorno orgánico fácilmente identificable. Esta perspectiva cambió positivamente en la década de 1960 gracias al progreso técnico y científico: los trabajos sobre la etiología y la fisiopatología de los TFI sentaron las bases de la comprensión orgánica de los TFI. Las décadas siguientes permitieron desprenderse de una visión “totalmente fisiológica” y profundizar en los procesos psicosociales relacionados antes de establecer finalmente el modelo biopsicosocial moderno de referencia.
ROMA, CUNA DE LA CLASIFICACIÓN
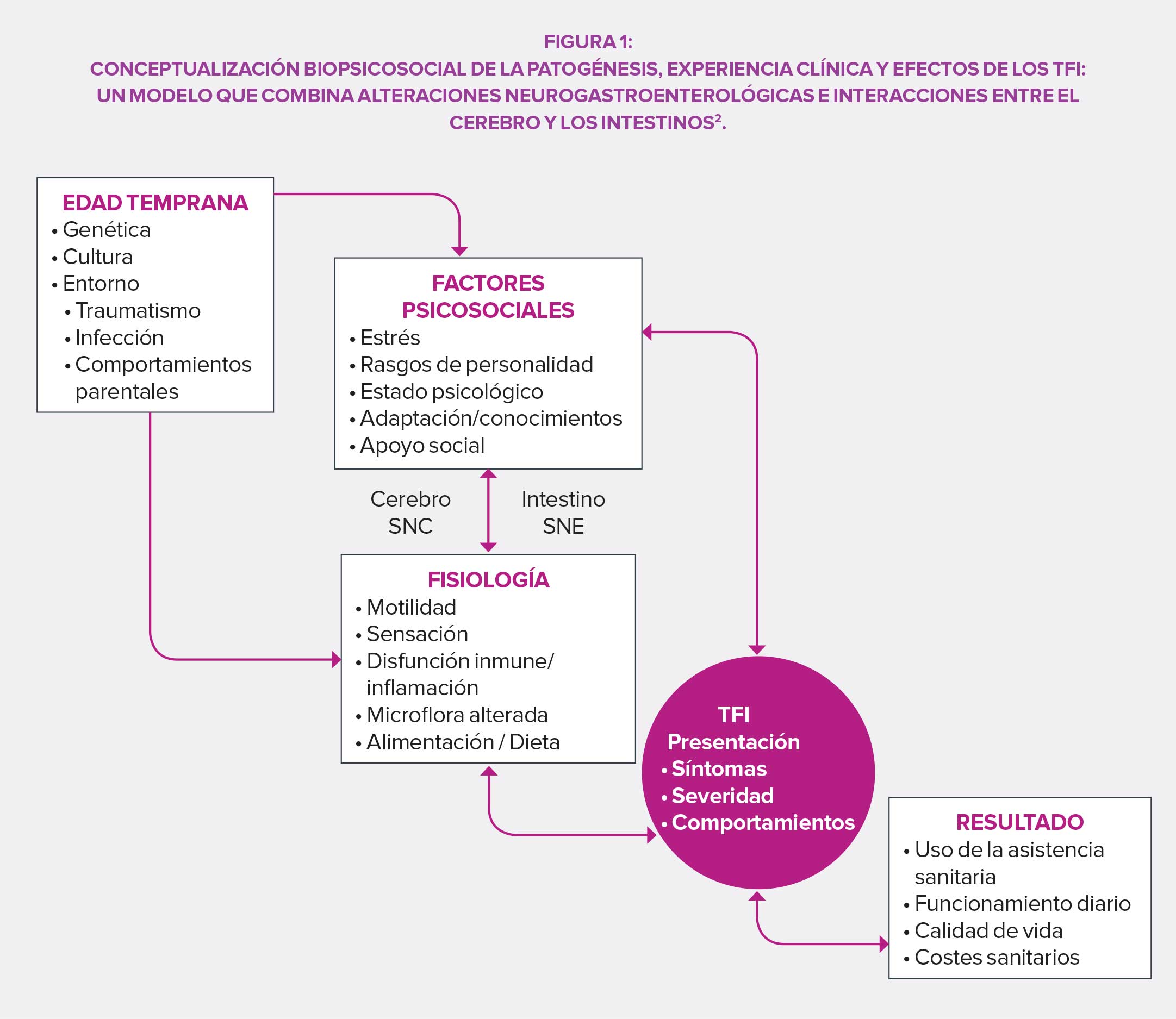
En la cuarta edición de su manual de referencia (Roma IV), la Fundación Roma propone una definición de los TFI diseñada de forma colaborativa por un comité de expertos: se trata de trastornos de la interacción intestino-cerebro, concretamente un “grupo de trastornos clasificados por síntomas gastrointestinales, relacionados con una combinación de lo siguiente: alteración de la motilidad, hipersensibilidad visceral, alteración de la función mucosa e inmunitaria, modificación de la microbiota intestinal y alteración de las funciones del sistema nervioso central (SNC)”. El resultado de esta reflexión permite no solo proponer una clasificación precisa de los TFI, sino también justificar su estudio y su tratamiento.
53 TIPOS DE TFI
El sistema de clasificación Roma IV se basa en criterios sintomáticos agrupados por región anatómica (esofágica, gastroduodenal, intestinal, biliar y anorrectal). Sin embargo, la localización sintomatológica por sí sola no es suficiente, especialmente en el caso del síndrome del intestino irritable (SII en español, IBS en inglés de Irritable Bowel Syndrome), las dispepsias funcionales o el síndrome de dolores abdominales (difíciles de ubicar y sujetos a efectos globales resultantes de la desregulación de las vías de señalización entre los sistemas nervioso central y entérico) mediado por el sistema nervioso central. Sus 33 categorías para adultos y 20 para bebés, niños y adolescentes garantizan un diagnóstico preciso y facilitan el establecimiento de un tratamiento personalizado. A este respecto, la Fundación Roma insiste en la importancia de no limitar las estrategias terapéuticas a la farmacoterapia y preconiza un enfoque biopsicosocial para responder a la variabilidad de los casos y a las expectativas de los pacientes con TFI.

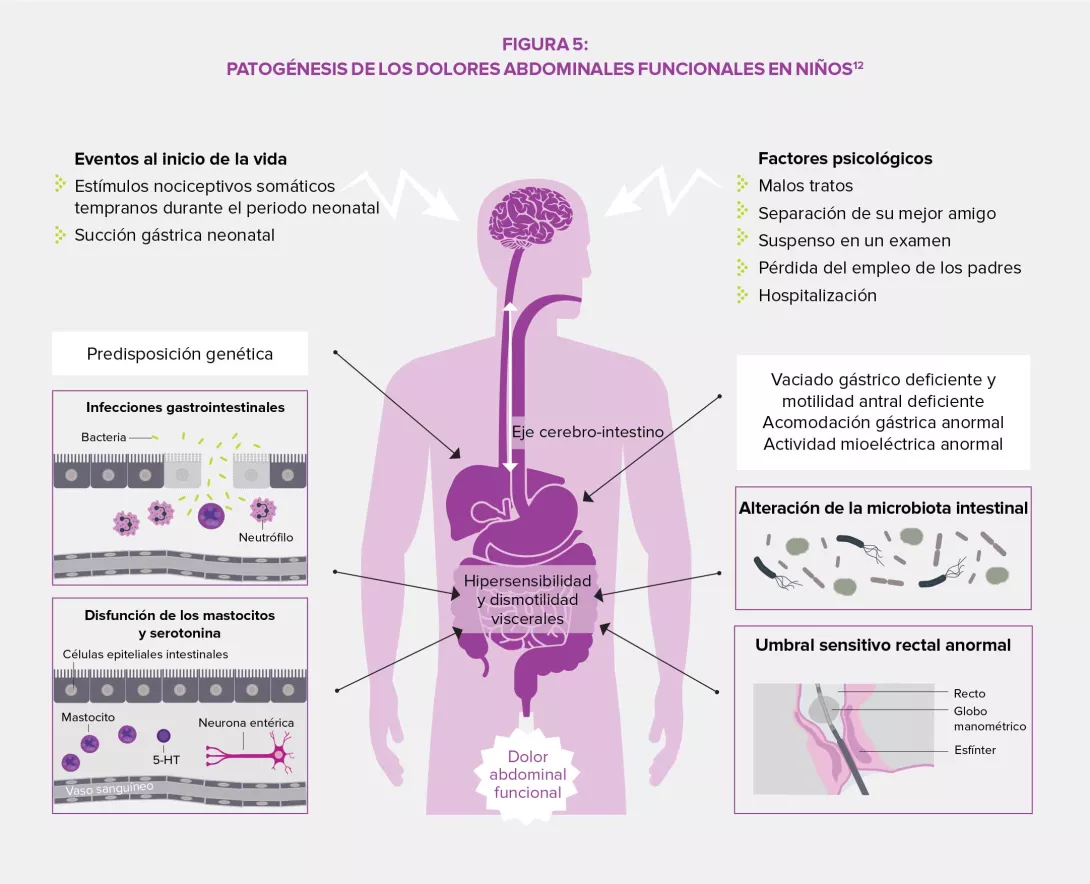
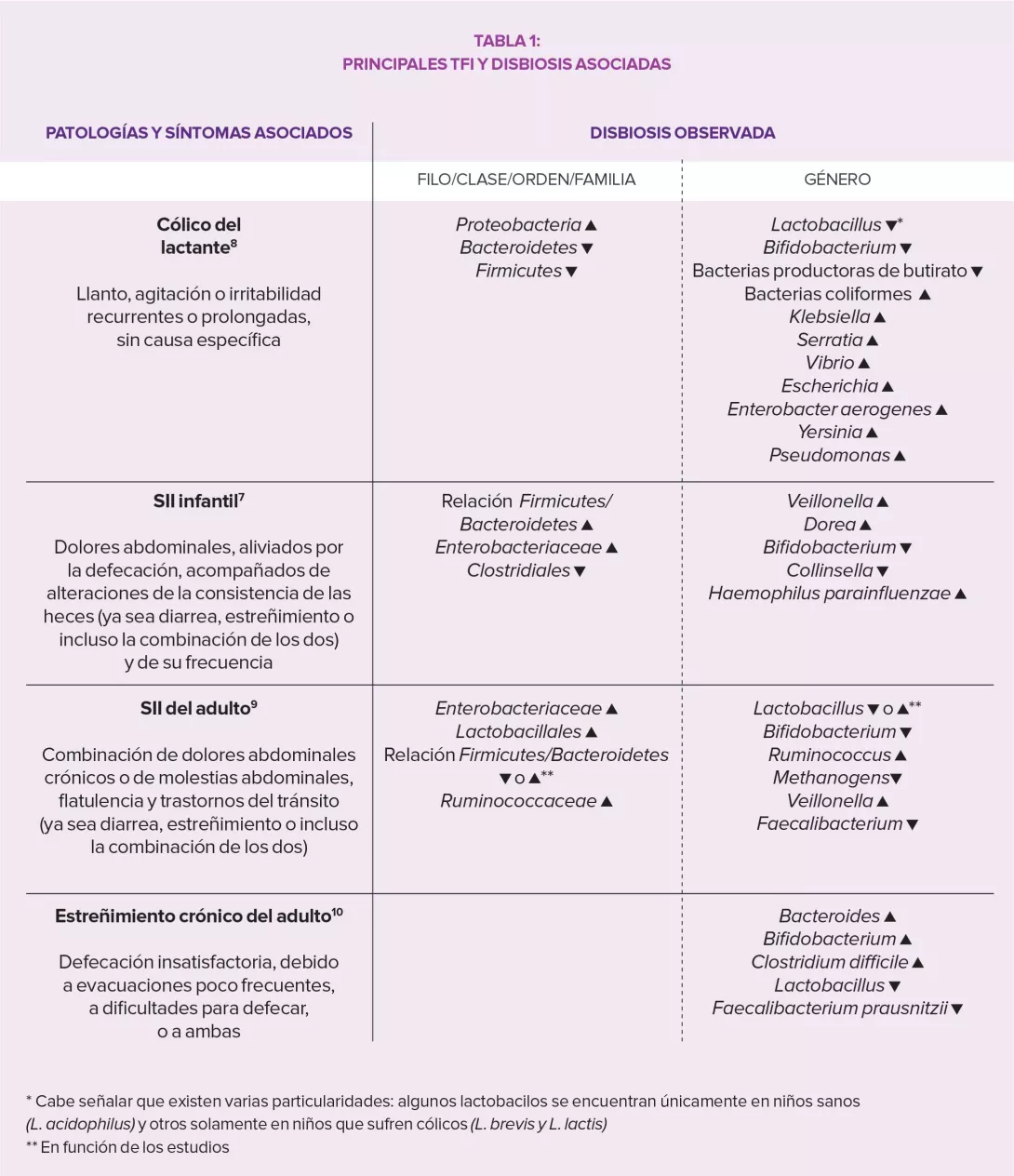
LA MICROBIOTA: UN PROTAGONISTA INTESTINAL DE PRIMERA IMPORTANCIA3,4
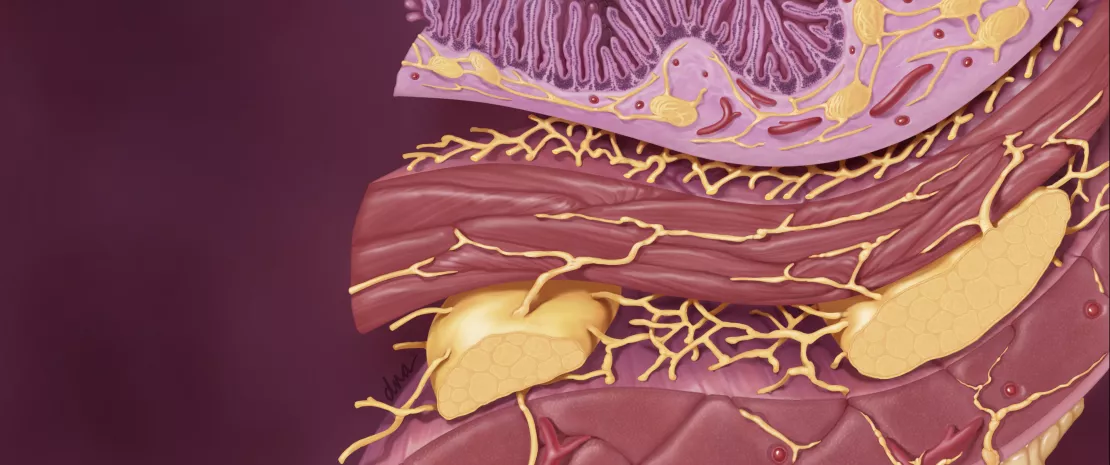
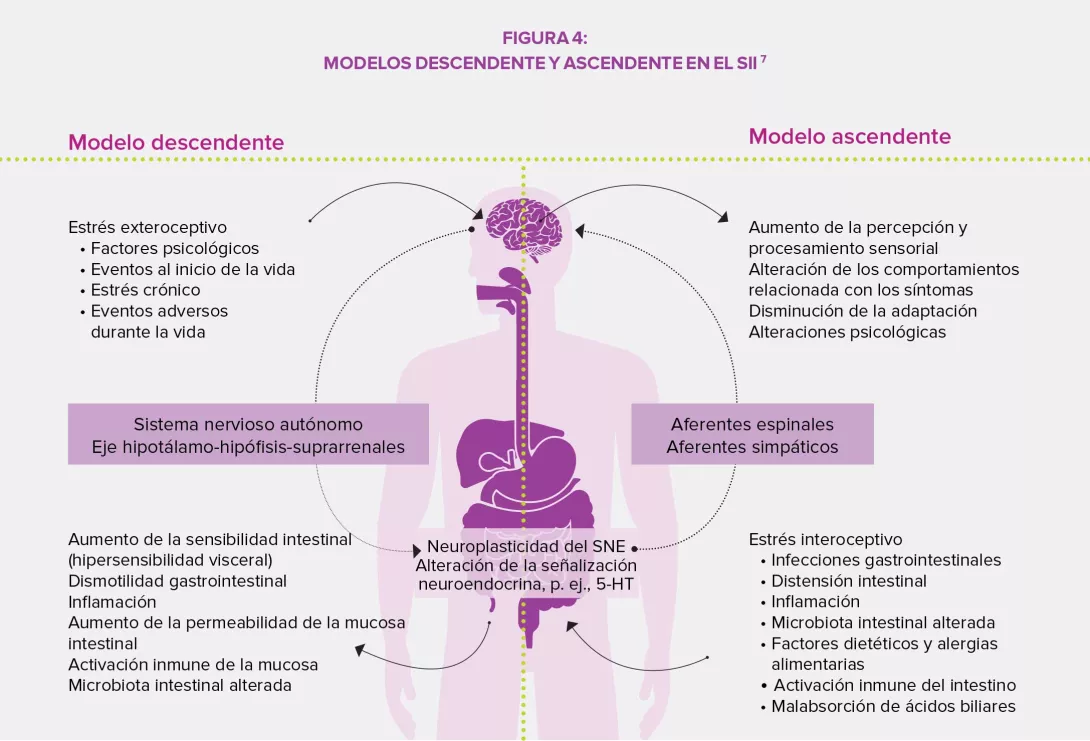
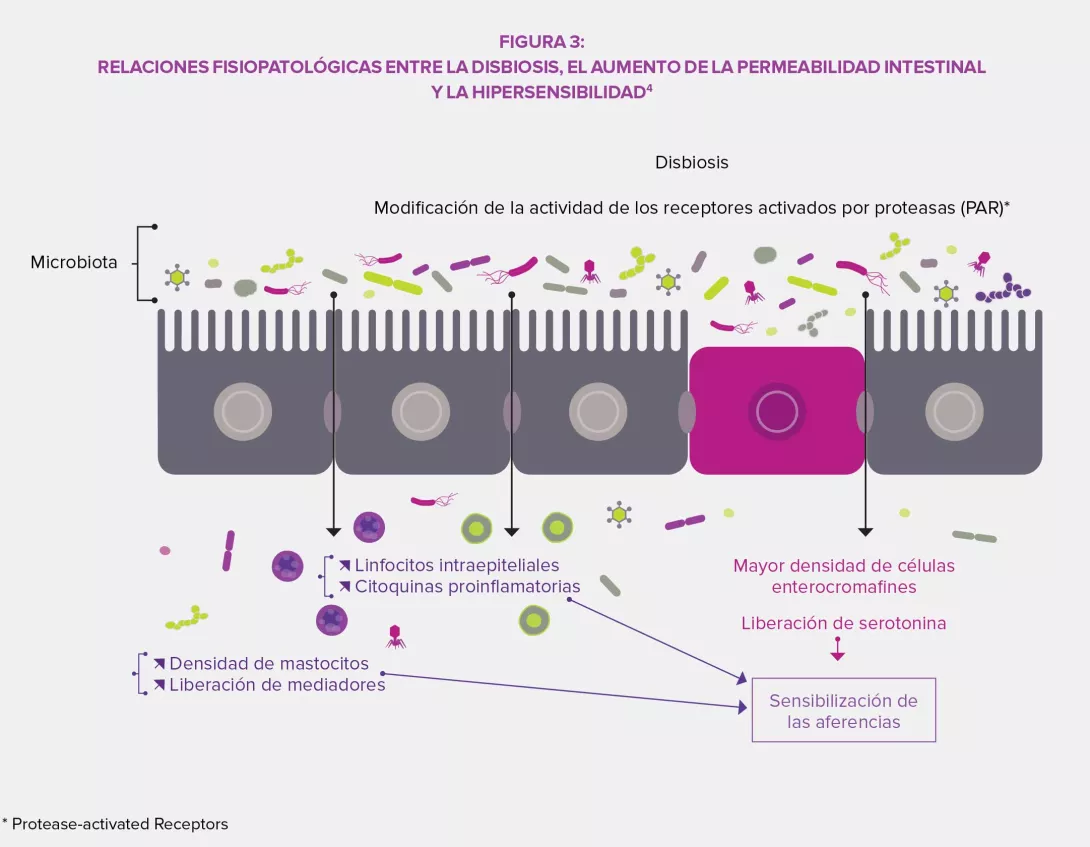
La microbiota intestinal ejerce una influencia compleja en el metabolismo, la nutrición y las funciones inmunitarias del huésped, y su alteración desempeña un papel fundamental en los TFI. La disbiosis se ha estudiado especialmente en el SII y los estudios en animales han demostrado que este desequilibrio estaría implicado en la hipersensibilidad visceral observada (a través de los ácidos biliares endoluminales), así como en los trastornos motores intestinales por la expresión de enzimas implicadas en la síntesis de neuromoduladores (por ejemplo, el ácido gamma-aminobutírico [GABA]) y los productos de fermentación cólica (gases o ácidos grasos de cadena corta AGCC). Por último, la disbiosis puede favorecer la alteración de la barrera intestinal: una mayor permeabilidad intestinal podría facilitar el paso de antígenos bacterianos responsables de una inflamación de bajo grado que conduce a una sensibilización de las aferencias sensitivas del sistema nervioso entérico.
UN ENFOQUE PROMETEDOR
La heterogeneidad de los TFI y los resultados contradictorios relativos a la composición bacteriana en función de los estudios y de las metodologías empleadas todavía impiden utilizar la microbiota y sus metabolitos como marcador válido de diagnóstico, seguimiento de la progresión de la enfermedad o respuesta al tratamiento. Sin embargo, la literatura científica confirma la importancia de la diversidad y composición de la microbiota intestinal en la fisiopatología de los TFI y, por consiguiente, los efectos potenciales de las estrategias relacionadas con la modulación de las poblaciones bacterianas intestinales.