¿Por qué ciertas personas son particularmente sensibles mientras que otras son más resistentes? “Es una cuestión de microbiota”, responden los investigadores, cuyos trabajos resaltan la importancia de las interacciones entre patógenos invasores y microorganismos que habitan nuestro intestino.
Una verdadera carrera de obstáculos
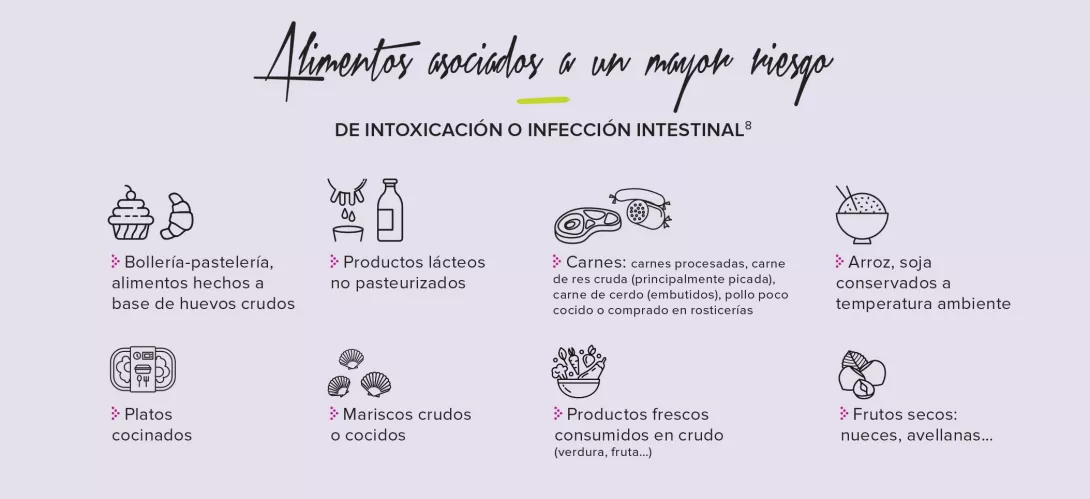
Con el objetivo de comprender el proceso infeccioso de las bacterias enteropatógenas, los investigadores examinaron los mecanismos que emplea el organismo para resistir a la colonización del tubo digestivo por Salmonella typhimurium14, una bacteria que causa intoxicaciones alimentarias y diarreas a veces severas, aunque de corta duración. El primer mecanismo de resistencia tiene lugar en el estómago, donde la acidez destruye entre el 95% y el 99% de las bacterias ingeridas. No todas las que llegan al intestino grueso consiguen el éxito: sólo pueden crecer si el nivel de resistencia a la colonización se lo permite. Sin embargo, esto último depende de la composición de la microbiota intestinal de cada uno, la cual dispone de diversos medios para impedir esta colonización: secreción de compuestos capaces de bloquear el crecimiento y la virulencia del invasor, competencia por los sitios de unión, creación de un entorno pobre en oxígeno y desfavorable para su crecimiento, etc.
Un formidable combate
Nuestras defensas no han dicho su última palabra: la cantidad de bacterias debe ser suficiente para desencadenar la diarrea, que puede aparecer entre las 12 y las 36 horas (incluso 72 horas dependiendo de la cantidad de bacterias ingeridas) tras atravesar la barrera Cuando las bacterias y los parásitos atacan la microbiota intestinal intestinal. Según modelos animales, S. typhimurium consigue atravesarla mediante la secreción de sustancias tóxicas que le permiten alcanzar la mucosa y la submucosa. El organismo reacciona mediante la expulsión de las células intestinales infectadas –lo que reduce a la centésima parte el número de bacterias patógenas en los tejidos– y desencadena una respuesta inflamatoria masiva que afecta al enemigo a través de dos mecanismos: la reducción de la carga bacteriana en el organismo y la función de carburante para las bacterias restantes.
Consecuencias a largo plazo
Otro enemigo es Giardia lamblia, un protozoo que infecta al hombre a través del consumo de agua o alimentos contaminados. Si la frecuencia de infecciones por Giardia no sobrepasa el 7% de la población en países desarrollados, puede alcanzar el 30% en los países en desarrollo. Generalmente, la infección se cura al cabo de algunas semanas, pero a veces, puede durar varios meses y convertirse en crónica. Por ahora no existe ninguna vacuna y los tratamientos tienen una eficacia variable. La giardiasis, a menudo asintomática, puede provocar diarrea, calambres y náuseas, pero la gravedad de la enfermedad radica sobre todo en sus consecuencias a largo plazo cuando afecta a los lactantes. A los dos años de edad, éstos muestran un importante retraso en el crecimiento; y algunas personas pueden desarrollar síndromes postinfecciosos varios años después de la eliminación del parásito, tales como el síndrome del intestino irritable o el síndrome de fatiga crónica. De acuerdo con diversos trabajos, Giardia lamblia actuaría disminuyendo la respuesta inmunitaria y provocando una disbiosis.

 ¿Bacterias intestinales devoradoras de colesterol?
¿Bacterias intestinales devoradoras de colesterol?