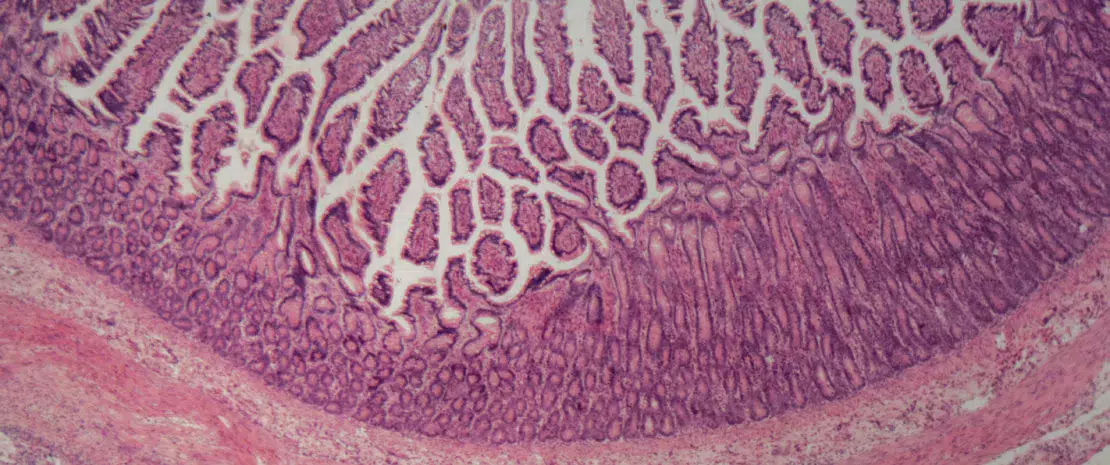
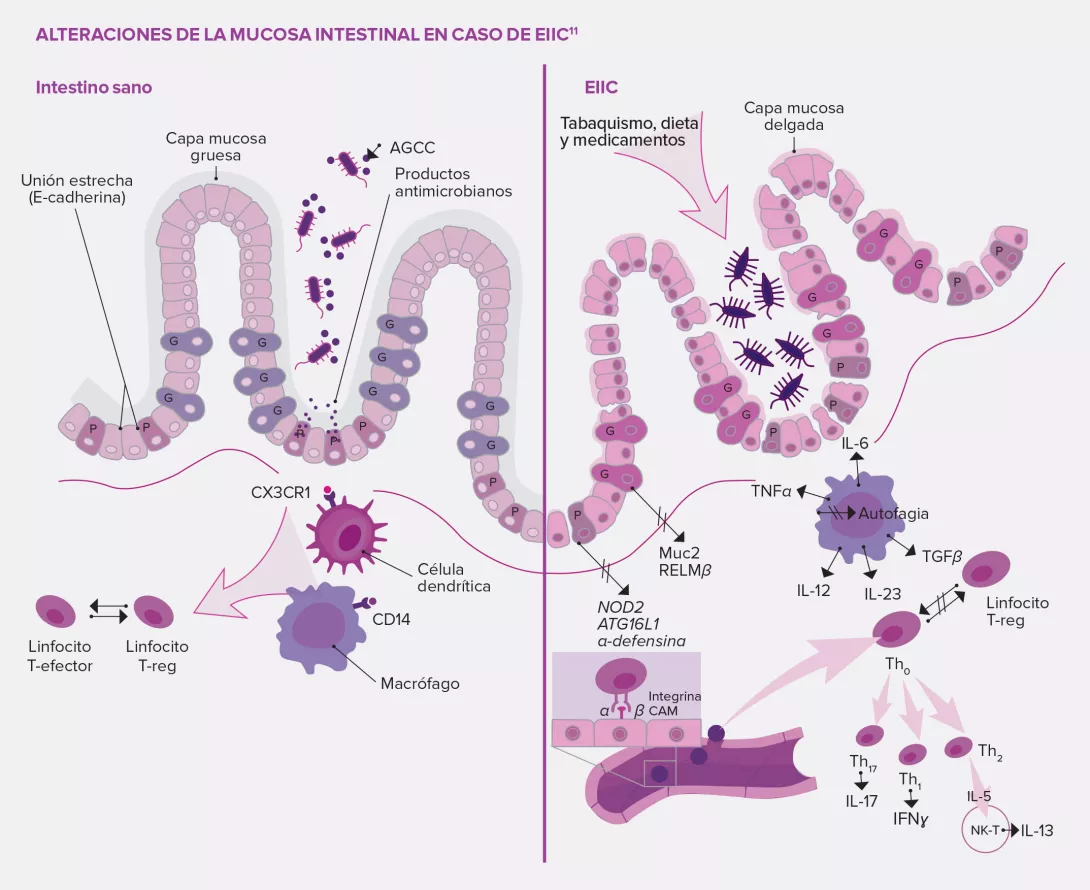
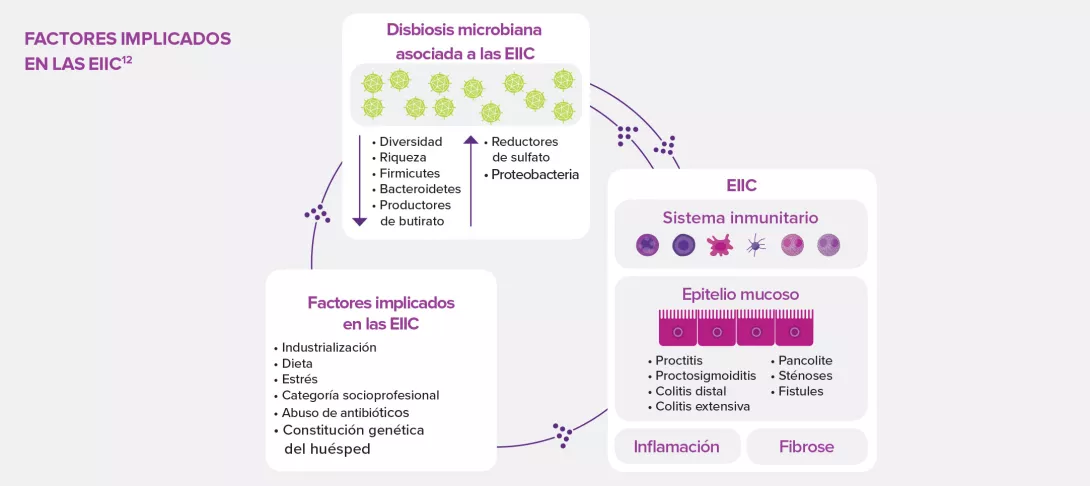
Los probióticos son microorganismos vivos cuyo consumo en cantidades adecuadas aporta beneficios para la salud. En las EIIC, los efectos beneficiosos de los probióticos se consiguen mediante varios mecanismos de acción como son la modificación de la composición microbiana intestinal que reduce la disbiosis intestinal, la regulación de la actividad metabólica de la microbiota intestinal, la eliminación del proceso proinflamatorio y la inmunomodulación12.
Resultados contrastados según la enfermedad
En la CU, los probióticos que contienen una única cepa (perteneciente a la especie E. coli), así como la leche fermentada por Bifidobacterium, demostraron una eficacia comparable a la obtenida con el tratamiento antiinflamatorio convencional (mesalazina)12 para conseguir la remisión de la enfermedad. También se probaron diferentes mezclas de cepas bacterianas sin que se obtuviera ningún resultado en materia de remisión de la enfermedad. Hubo, sin embargo, una excepción: un cóctel de 8 cepas diferentes15, indujo una reducción de los síntomas de CU13,16 (hemorragia rectal y frecuencia de deposiciones) y otro estudio demostró su eficacia para mantener esta remisión. Este mismo cóctel parece también eficaz en caso de reservoritis: previene los brotes inflamatorios consecutivos a la coloproctectomía y mantiene la remisión de la enfermedad en los pacientes17,18. En definitiva, los probióticos no han demostrado ser de interés para el tratamiento de la EC en la actualidad. Los resultados de los pocos estudios realizados no son consistentes ni concluyentes, incluidos aquellos con cepas que han mostrado ser eficaces en la CU y la reservoritis12,15.
Continúan las investigaciones
La heterogeneidad de los resultados preclínicos y clínicos podría deberse, al menos en parte, a factores relacionados con el huésped (edad, sexo, dieta, localización de la enfermedad, gravedad, antecedentes familiares de EIIC) y con los probióticos empleados (tipo de cepa, concentración, modo de administración, colonización potencial y tasa de supervivencia de las cepas). También es de suponer que otros factores como la dosis y la duración del tratamiento con probióticos tengan un papel importante en el éxito de esta estrategia terapéutica cuyos efectos adversos son mínimos o incluso inexistentes12