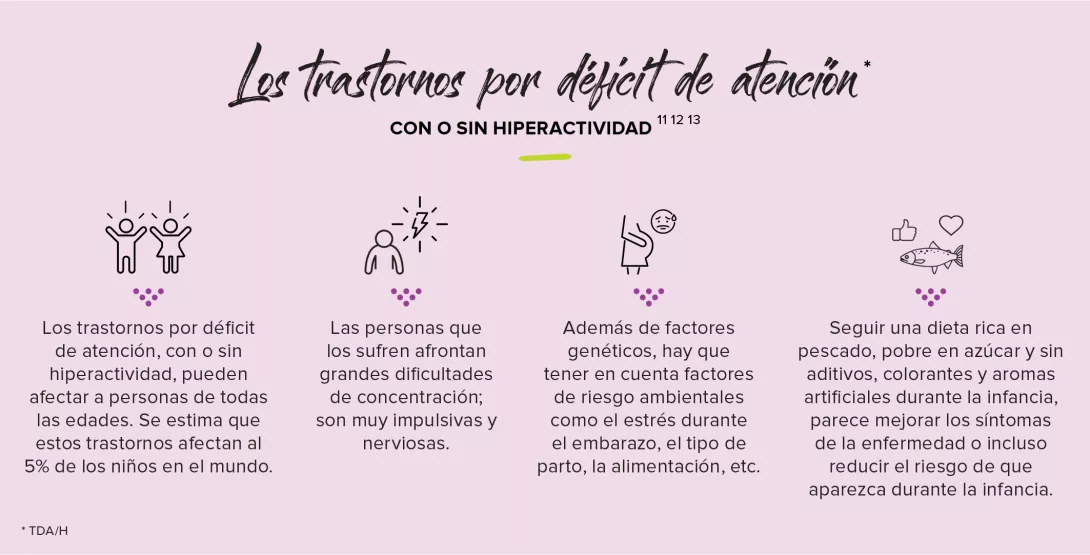
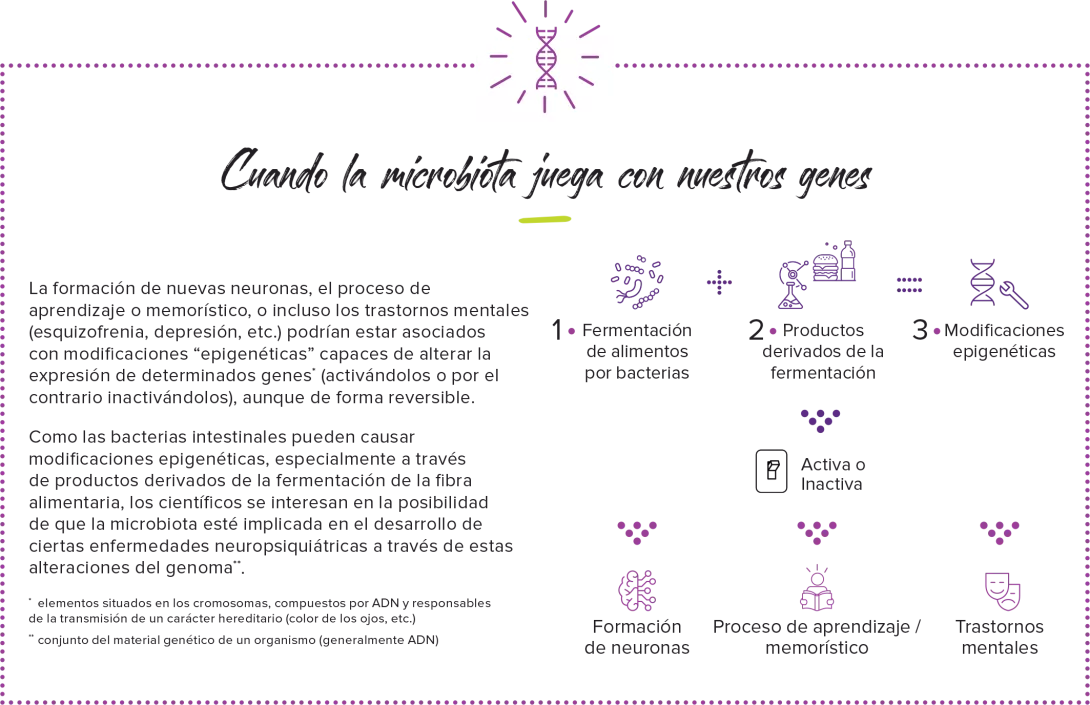
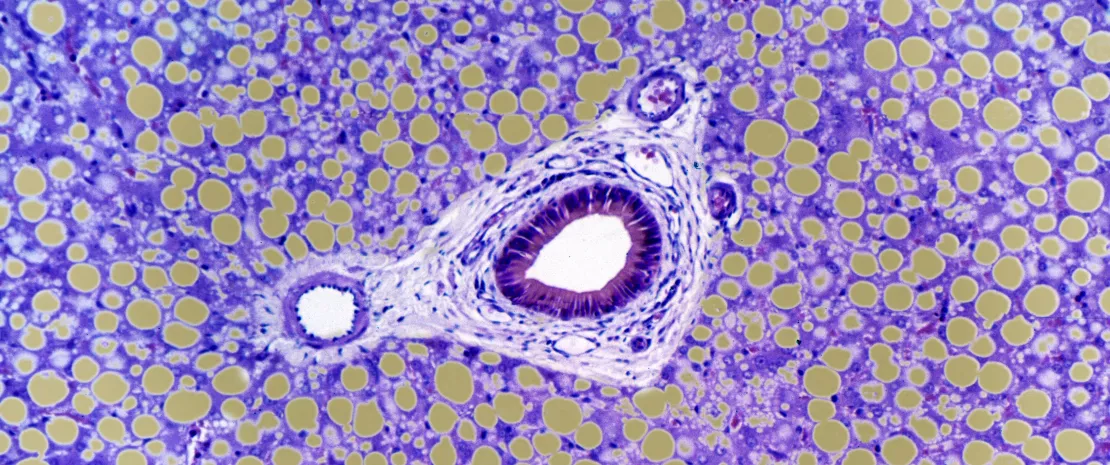
Aunque la hepatitis alcohólica es una enfermedad asociada a una mortalidad elevada, la falta de innovación está afectando a su pronóstico y tratamiento. Recientemente se ha puesto de manifiesto el papel que ejerce el eje intestino-hígado en las complicaciones del alcoholismo, especialmente a través de la translocación bacteriana desde el intestino al hígado. ¿Podría estar implicada una disbiosis fúngica?
Proliferación de Candida
Un equipo de investigación internacional analizó, a partir de una cohorte estadounidense y europea, la micobiota intestinal de 59 pacientes con hepatitis alcohólica, 15 pacientes que consumían alcohol de forma abusiva* y que presentaban diferentes estadios de daño hepático y 11 controles sanos. Se observó una clara proliferación de Candida en ambos grupos de enfermos, así como una menor riqueza y diversidad fúngica con respecto al grupo control en el que predominaba el género Penicillium. Además, se estableció una correlación entre la micobiota intestinal y ciertos parámetros clínicos, en particular entre la presencia de Candida y un aumento de la fibrosis pericelular, y entre Penicillium y una reducción de la inflamación y de los cuerpos de Mallory**.
Mayor respuesta inmunitaria
Se cuantificaron los anticuerpos anti-Saccharomyces cerevisiae (ASCA) con el objetivo de detectar posibles respuestas inmunitarias frente a las especies fúngicas, particularmente frente a Candida albicans. Los niveles de ASCA eran significativamente mayores en el grupo de enfermos con hepatitis alcohólica con respecto a los otros dos grupos, lo que los autores atribuyeron a la combinación de dos factores: aumento de la concentración de Candida y alteración de la fagocitosis fúngica. Esta combinación desencadenaría una mayor respuesta inmunitaria, a diferencia de lo que sucede en pacientes que consumen alcohol de forma abusiva, en quienes se mantiene la fagocitosis. Además, la concentración de ASCA y la mortalidad aparecen relacionadas: con concentraciones iguales o superiores a 34 UI/mL, la mortalidad a los 90 y 180 días fue significativamente mayor, independientemente de otros factores de confusión [corticoides o pentoxifilina (tratamientos de referencia), puntuación MELD***, translocación bacteriana].
Nuevas opciones en el punto de mira
Otros estudios han demostrado que los pacientes cirróticos tienen un mayor riesgo de contraer una infección fúngica, siendo la aspergilosis una complicación frecuente y a menudo mortal de la hepatitis alcohólica. Según los autores, la micobiota intestinal parece ser una diana terapéutica potencial que merece ser estudiada. Lo mismo sucede con la concentración de ASCA y la puntuación MELD, dos parámetros que podrían mejorar el diagnóstico en relación con el riesgo de mortalidad. Sin embargo, será necesario previamente confirmar estos resultados ya que el número de pacientes del estudio fue relativamente bajo y el consumo de antibióticos en algunos de ellos pudo haber afectado la composición de la micobiota intestinal.
* En el estudio, el consumo abusivo de alcohol en pacientes con hepatitis alcohólica se definió como un consumo superior a 50 g/día en los hombres y 40 g/día en las mujeres en los 3 últimos meses; se considera no abusivo un consumo inferior a 20 g/día.
** Acumulaciones residuales de microfilamentos secundarios a la toxicidad del alcohol y sus metabolitos.
*** Model for end stage liver disease: puntuación de referencia establecida a partir del INR (relación normalizada internacional representativa del tiempo de hemorragia), la concentración de bilirrubina y la de creatinina.

 ¿La ansiedad crónica posiblemente influenciada por bacterias intestinales?
¿La ansiedad crónica posiblemente influenciada por bacterias intestinales?