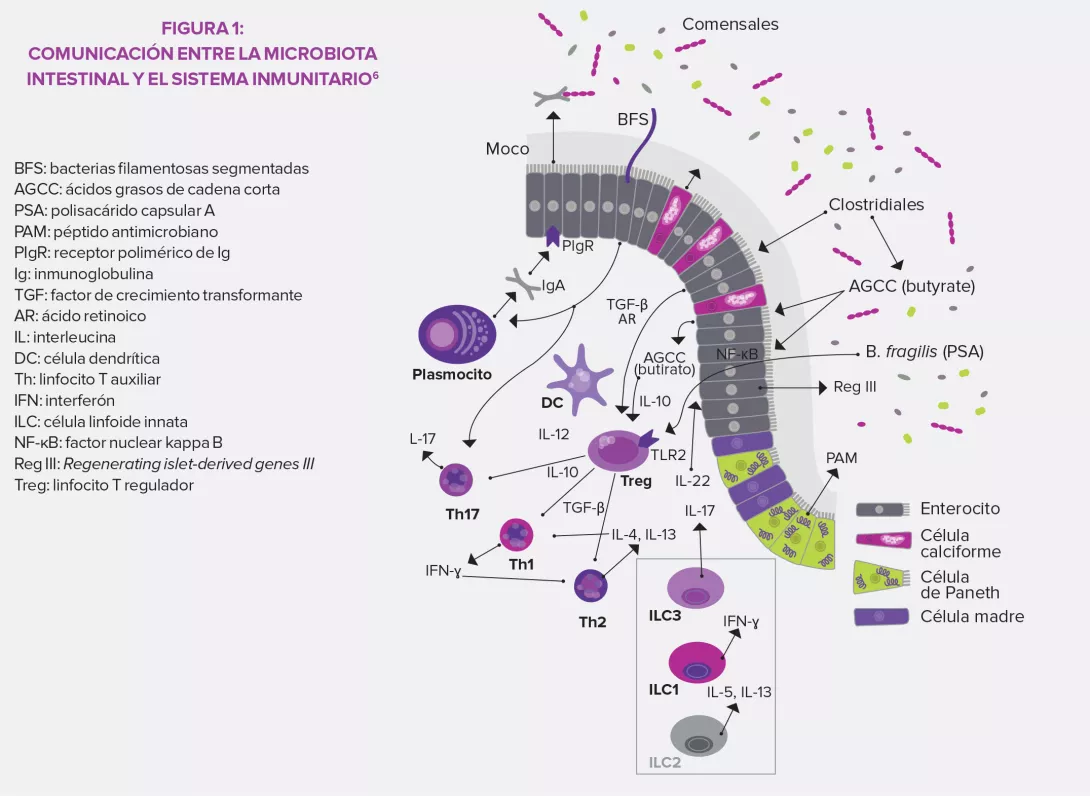
La hiperglucemia, el exceso de lípidos en la sangre y la hipertensión son efectos bien conocidos de una alimentación demasiado rica en grasas; sin embargo, no representan más que la punta del iceberg. Al profundizar en el tema, los investigadores descubrieron el papel destacado de la microbiota intestinal en estas alteraciones del metabolismo. Y al mismo tiempo distinguieron la grasa buena de la mala.
En ratones de laboratorio alimentados con un pienso muy graso como la dieta de los pacientes con síndrome metabólico, el resultado fue el mismo: su flora intestinal no se parece a la de sus congéneres con buena salud; demasiada grasa todos los días reduce, por ejemplo, la cantidad de Akkermansia muciniphila, una bacteria beneficiosa que mejora la glucemia y la sensibilidad a la insulina, y protege frente a la formación de placas grasas en los vasos (la ateroesclerosis). Como su nombre indica, esta bacteria produce también una sustancia llamada “mucina” que consolida el moco protector de la barrera intestinal. Otro efecto colateral del exceso de grasa alimentaria es la disminución de los lactobacilos y bifidobacterias, que son bacterias “buenas” que reducen la inflamación y la formación de tejido adiposo.
No todas las grasas son iguales
Pero, ¿de qué grasas estamos hablando? Los ácidos grasos saturados como el aceite de palma deben sin lugar a dudas evitarse, tal y como nos recalcan los mensajes de salud pública: están relacionados con un descenso de la diversidad bacteriana y con un aumento de peso. Por el contrario, el ácido oleico presente en el aceite de oliva, que es un ácido graso monoinsaturado de la familia de los omega-9, podría restaurar la diversidad bacteriana y reducir el peso —al menos en ratones—. De la misma forma habría que apostar por los ácidos grasos poliinsaturados de tipo omega-3, como el aceite de pescado, que favorecen la presencia de Akkermansia muciniphila, lactobacilos y bifidobacterias. Además, estos omega-3 deben prevalecer sobre los omega-6 ya que estos últimos, aunque también son esenciales para el organismo, deben consumirse con moderación porque mantienen la inflamación y la reducción de bifidobacterias.
“Para empezar come tu ración de fibra”
Y como las grasas no lo son todo, ni para bien ni para mal, existe otro grupo de alimentos que influye en el equilibrio metabólico: la fibra. Se trata de azúcares no digeribles presentes en los cereales, tubérculos, nueces, semillas, frutas y verduras. En ausencia de fibras que fermentar para extraer la energía en forma de AGCC, las bacterias comienzan a erosionar el moco protector que tapiza nuestras células intestinales, exponiéndolas a invasiones bacterianas. Además, la fibra permite un mejor control de la glucemia, probablemente gracias a la presencia de Prevotella en nuestros intestinos. Moraleja: por el bien de su microbiota, consuma grasa con moderación –y de la buena– y no se olvide de la fibra!