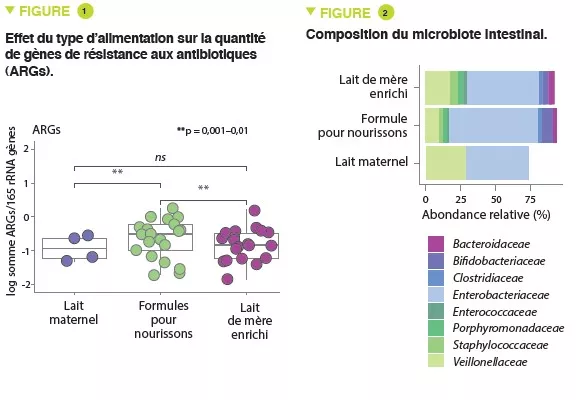
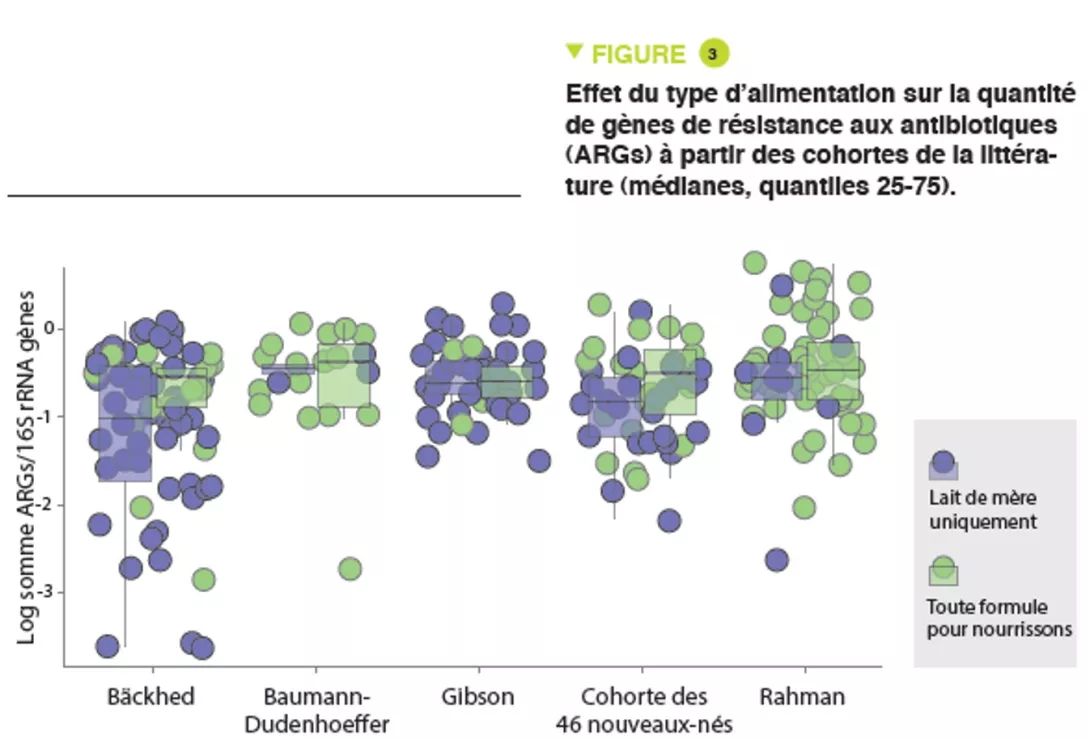
Cette méthode s’est récemment révélée être un moyen simple et direct de mesurer le temps de transit intestinal. Il s’agit du temps que mettent les aliments à traverser notre tractus gastro-intestinal, de l’ingestion à l’évacuation, et il est généralement évalué pour mesurer la motilité intestinale, qui est un élément clé de la santé intestinale. Dans une étude récente [1] d’Asnicar et de ses collègues, publiée dans Gut, les auteurs ont évalué la méthode du colorant bleu comme marqueur du temps de transit intestinal, et son association avec des marqueurs de santé spécifiques (notamment la consistance et la fréquence des selles, la composition et la fonction du microbiome intestinal, et la santé cardiométabolique) chez 863 personnes en bonne santé.
Ils ont tout d’abord constaté que la consistance plus dure des selles, mesurée à l’aide du British Stool Chart, est associée à un temps de transit intestinal plus long (> 5 jours en médiane pour le type 1), tandis que la consistance plus molle correspond à un temps de transit intestinal plus court (1 jour en médiane pour le type 6).
En outre, ils ont également constaté que le temps de transit intestinal est associé à plusieurs caractéristiques du microbiome intestinal. La diversité alpha, qui est un marqueur de la santé microbienne, était positivement corrélée au temps de transit intestinal. Un temps de transit intestinal plus long était associé à des taxons microbiens spécifiques, notamment Akkermansia muciniphila (une souche bénéfique aux propriétés métaboliques favorables), Bacteroides spp. et Alistipes spp. De manière générale, le temps de transit intestinal était associé aux caractéristiques du microbiome intestinal plus que la consistance ou la fréquence des selles.
Enfin, un temps de transit plus long était associé à la masse de graisse viscérale et aux réponses lipidiques et glycémiques postprandiales (deux facteurs de risque cardiovasculaire).
En conclusion, la méthode du colorant bleu semble être un marqueur simple et peu coûteux du temps de transit intestinal, qui s’est avéré être associé à des marqueurs de la santé humaine, notamment la diversité et la composition du microbiome intestinal, et à des facteurs de risque cardiovasculaire spécifiques. Il pourrait s’agir d’une méthode fiable pour évaluer le temps de transit intestinal en cas de besoin, c’est-à-dire chez les patients souffrant de constipation).
La façon dont cette procédure est diffusée (expansion virale par les médias sociaux) laisse penser que de nombreux patients demanderont ce test aux médecins. Comme pour tous les examens demandés par les patients, je recommanderais d’abord une visite chez un professionnel de la santé spécialisé dans les maladies digestives pour éviter de faire du système D. Ensuite, si les médecins confirment la nécessité d’un test de temps de transit intestinal, la méthode du colorant bleu serait alors fiable et bon marché.
De futures évaluations, y compris des comparaisons avec d’autres méthodes d’évaluation du transit intestinal, sont nécessaires pour confirmer ces résultats et permettre un positionnement à grande échelle de cet outil dans l’arsenal diagnostique des troubles digestifs et nutritionnels.

 VIH, affections de la bouche et microbiote oral : des liens à explorer
VIH, affections de la bouche et microbiote oral : des liens à explorer
 Microbiote vaginal et papillomavirus humains (HPV) : des bactéries qui font le ménage !
Microbiote vaginal et papillomavirus humains (HPV) : des bactéries qui font le ménage !