Co oznacza tajemniczo brzmiące pojęcie „dysbiozy”?
Dysbioza to zaburzenie delikatnej równowagi pomiędzy miliardami mikroorganizmów naszej ludzkiej mikrobioty a ich dobrymi relacjami z naszym organizmem. Predyspozycje genetyczne, niezbilansowana dieta, antybiotyki itd. – istnieje wiele różnych czynników powodujących dysbiozę. Obecnie badania naukowe wykazują, że dysbioza mikrobioty jelitowej (najczęściej badanej), ale także innych naszych mikrobiot, takich jak mikrobiota pochwy, skóry czy płuc, jest związana z różnymi chorobami, od zespołu jelita drażliwego po zaburzenia metaboliczne, takie jak otyłość, poprzez przewlekłe zapalenie zatok i egzemę. W jaki sposób może dojść do zaburzenia równowagi mikrobioty? Jakie są konsekwencje dysbiozy dla naszego zdrowia? Jak przywrócić równowagę mikrobioty?
Wyjaśniamy!

Co to jest dysbioza?
Najpierw przyjrzyjmy się samemu słowu: „dysbioza”. Etymologia tego naukowego terminu jest bardzo prosta! W języku greckim słowo bios oznacza „żywy”, a przedrostek dys- oznacza „zły”.
„Dysbioza” może być zdefiniowana jako zmiana w składzie i funkcjonowaniu mikrobioty. Zmiana ta jest wynikiem połączenia czynników środowiskowych i czynników specyficznych dla każdej osoby1.
Ponieważ mikroorganizmy kolonizują całe nasze ciało, dysbiozę można zaobserwować w przypadku:
- Mikrobioty jelitowej: różne choroby zostały powiązane z dysbiozą jelit: biegunka związana z antybiotykami14, nieżyt żołądkowo-jelitowy17, kolka niemowlęca44…
- Mikrobioty skóry: dysbioza jest często związana ze stanami patologicznymi (trądzik45, atopowe zapalenie skóry46)
- Mikrobioty pochwy: dysbioza pochwy jest związana z bakteryjnym zapaleniem pochwy1, kandydozą47, zmniejszoną płodnością48 lub wyższym ryzykiem przedwczesnego porodu1
- Mikrobioty ENT (ucho, nos, gardło): różne choroby mogą być związane z brakiem równowagi mikrobioty jamy ustnej, małżowiny usznej lub nosogardzieli
- Mikrobioty płucnej: dysbioza może przyczyniać się do rozwoju zimowych infekcji dróg oddechowych49, astmy50, mukowiscydozy51
- Mikrobioty układu moczowego: opublikowane dotychczas badania wykazały rolę, jaką mikrobiota układu moczowego może odgrywać w infekcjach dróg moczowych52
Dysbioza nadciąga: niepokoje mikrobioty jelitowej
Mikrobiota jelitowa jest główną mikrobiotą ludzkiego organizmu2. Zawiera co najmniej 1000 różnych gatunków3 mikroorganizmów, w tym bakterie, grzyby i wirusy. Grupa Firmicutes (która obejmuje znane nam „dobre bakterie”, pałeczki kwasu mlekowego) i grupa Bacteroidetes stanowią łącznie 70–90% bakterii w naszych jelitach2-4. Nasza mikrobiota zawiera również Actinobacteria, do których należą bifidobakterie, znane ze swoich dobroczynnych właściwości. Inne mikroorganizmy w naszej mikrobiocie mogą powodować choroby. Są one określane jako „potencjalne (sidenote: Patogen patogen to mikroorganizm, który powoduje lub może spowodować chorobę Pirofski LA, Casadevall A. Q and A: What is a pathogen? A question that begs the point. BMC Biol. 2012 Jan 31;10:6. ) ”, ale stanowią mniejszość2. Dysbioza objawia się jednym lub kilkoma zjawiskami:
- Znacząca zmiana względnych proporcji głównych rodzin bakterii, w szczególności utrata pałeczek kwasu mlekowego i bifidobakterii5;
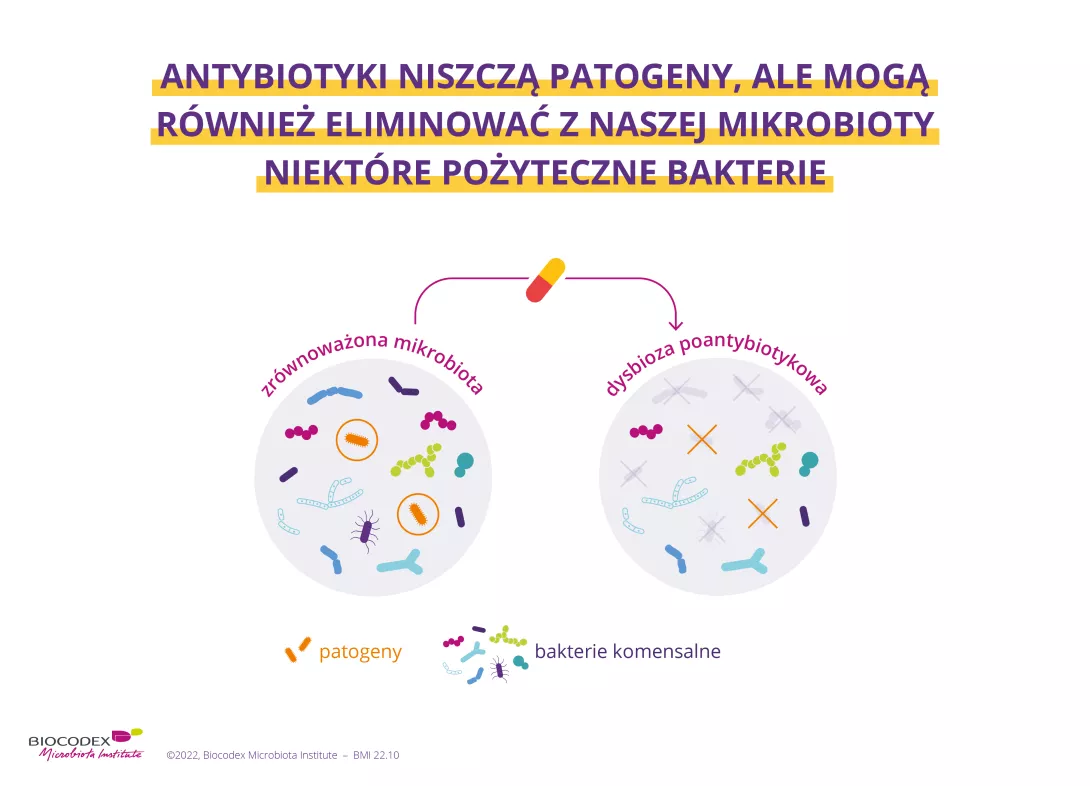
- Liczba pożytecznych mikroorganizmów, normalnie obecnych w naszej mikrobiocie (tzw. „komensali”), ulega zmniejszeniu lub całkowitemu wyparciu1;
- Zmniejsza się różnorodność mikroorganizmów w mikrobiocie – jest mniej różnych gatunków5;
- Potencjalne patogeny obecne w mikrobiocie namnażają się1,5.
W rezultacie nasza mikrobiota jest osłabiona, a „złe” bakterie przejmują kontrolę nad „dobrymi”2. Mikrobiocie trudniej jest chronić organizm przed atakami i pełnić podstawowe funkcje związane z naszym zdrowiem i dobrym samopoczuciem 1,6.
1000 Składa się z co najmniej 1000 różnych gatunków mikroorganizmów.
Jak wygląda dysbioza?
Chociaż dysbioza sama w sobie nie jest uważana za chorobę, jest ona powiązana z różnymi problemami zdrowotnymi i może przyczyniać się do rozwoju lub zaostrzenia niektórych schorzeń.
Indywidualna specyfika zaburzeń równowagi mikrobioty
Dysbioza nie jest jednak pojęciem uniwersalnym, które można stosować do wszystkich osób i w każdych okolicznościach.1 Pod wpływem naszych genów oraz mikroorganizmów (definicja: żywe organizmy, które są zbyt małe, aby można je było zobaczyć gołym okiem. Należą do nich bakterie, wirusy, grzyby, archeony, pierwotniaki itp. i są one powszechnie określane jako „ (sidenote: https://microbiologysociety.org/why-microbiology-matters/what-is-microbiology.html ) ”), które zasiedlają nasz organizm w pierwszych latach życia, skład naszej mikrobioty jest indywidualny. Różni się tak bardzo u poszczególnych osób jak odciski palców.7 Mikrobiota może jednak ulegać zmianom w zależności od naszego wieku, stanu zdrowia, czynników stresu, diety, miejsca zamieszkania, przyjmowanych leków itp.8 Dlatego każda osoba może mieć „swoją” dysbiozę, w przypadku gdy jej mikrobiota traci równowagę i nie funkcjonuje już prawidłowo w organizmie.1
Czym jest więc zrównoważona mikrobiota?
Przedrostek „dys-” w słowie „dysbioza” jest przeciwieństwem „eu-” („dobry”) lub „sym-” („z”). O „symbiozie” mówimy wtedy, kiedy nasza mikrobiota jest zdrowa – harmonijnie współdziała z naszym organizmem, a jej społeczność mikrobiologiczna jest zrównoważona1.
Istnieje wzajemna zależność pomiędzy miliardami mikroorganizmów, które zasiedlają mikrobiotę, i naszym organizmem9. Obie strony na tym korzystają – nasz organizm zapewnia „pożywienie i schronienie” mikroorganizmom mikrobioty, a one z kolei przyczyniają się do wielu ważnych funkcji naszego organizmu, takich jak trawienie, przyswajanie składników odżywczych, ochrona nieprzepuszczalności ściany jelita oraz walka z niepożądanymi drobnoustrojami2,8,10. Jest to prawdziwa praca zespołowa!
Różni mieszkańcy naszej mikrobioty, w tym potencjalne patogeny, występują w odpowiedniej liczbie i proporcjach, co umożliwia ich pokojowe współistnienie i pełnienie korzystnych funkcji w organizmie. Ta subtelna równowaga pomiędzy ekosystemami mikrobów naszego organizmu może jednak zostać zachwiana: eubioza przechodzi wtedy w dysbiozę8.
Co powoduje dysbiozę?
Jak sama nazwa wskazuje, dysbioza może być spowodowana wieloma różnymi, często wzajemnie powiązanymi, czynnikami.5 Wyszczególnijmy niektóre z nich:
Czynniki indywidualne, takie jak:
- predyspozycje genetyczne;1
- wiek;11
- niektóre choroby i urazy;1
Czynniki środowiskowe, takie jak:
- przyjmowanie leków: antybiotyków, środków przeciwzapalnych itp;2,5
- infekcje;12
- styl życia: niezrównoważona dieta lub zmiany w diecie, stres, palenie tytoniu, niewłaściwa higiena itp.);1, 5, 8
- zanieczyszczenie środowiska8
Co może powodować dysbiozę?
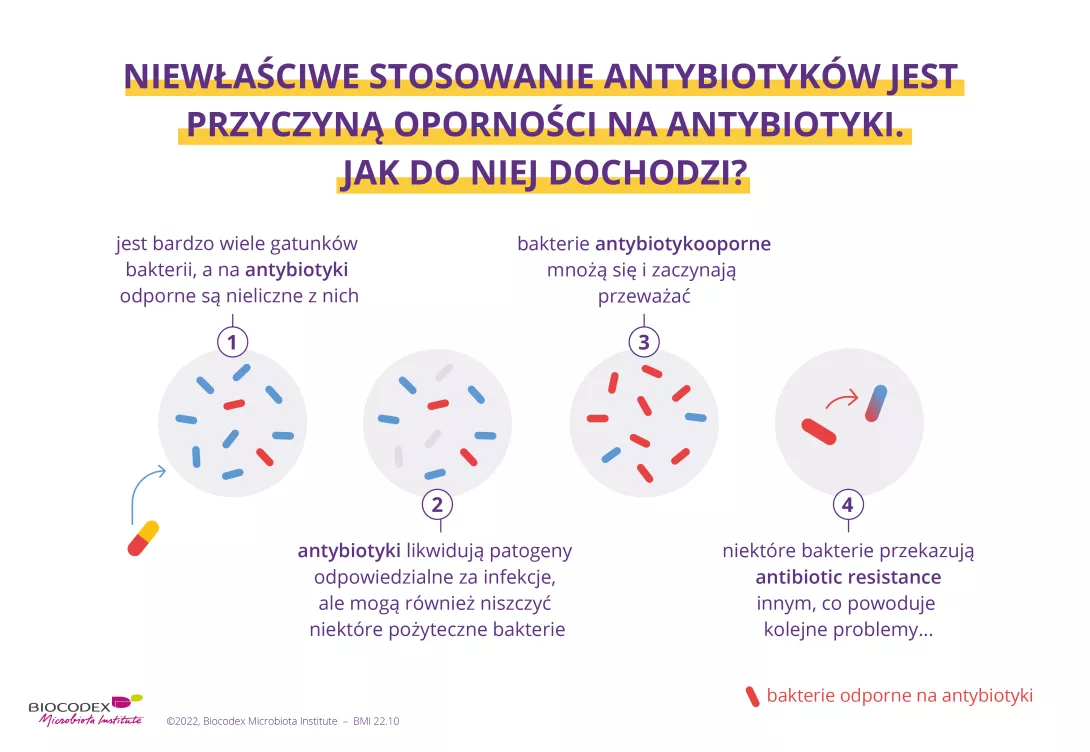
Antybiotyki są jednym z najważniejszych osiągnięć medycyny w XX wieku. Od czasu odkrycia penicyliny w 1928 roku uratowały życie milionom ludzi.13 Jednak niszcząc szkodliwe drobnoustroje, niszczą także „dobre” bakterie, zaburzając równowagę mikrobioty. Dysbioza wywołane antybiotykami może powodować skutki krótkoterminowe w postaci biegunki14 lub grzybicy pochwy.15 Podejrzewa się również, że wywołana antybiotykami dysbioza jelitowa może mieć długotrwałe skutki, zwłaszcza gdy antybiotyki są przyjmowane w dzieciństwie, poprzez zwiększenie ryzyka wystąpienia różnych chorób przewlekłych, takich jak otyłość czy alergie.16
Podczas infekcji, takich jak wirusowe zapalenie żołądka i jelit lub zatrucie pokarmowe salmonellą, drobnoustroje chorobotwórcze mogą zawładnąć ludzką mikrobiotą. Nie pochodzą one z mikrobioty, lecz ze środowiska zewnętrznego, przenoszone są np. przez brudne ręce lub zanieczyszczoną żywność. Infekcje te wywołują silną reakcję naszego układu odpornościowego objawiającą się zapaleniem jelit i biegunką. Wszystko to skutkuje nagłym zaburzeniem równowagi naszej flory jelitowej. Ponadto mikroby wywołujące infekcje mogą również sprzyjać rozwojowi innych potencjalnie patogennych bakterii obecnych w mikrobiocie. Infekcje prowadzą zatem do dysbiozy, którą wykorzystują wszystkie szkodliwe bakterie! 1,12,17,18
To, co jemy, ma wpływ na naszą mikrobiotę przez całe życie. Nagła zmiana diety, zarówno pod względem składu, jak i ilości, może wywołać dysbiozę. Ale nie tylko: podczas gdy normalne zmiany w naszym jadłospisie z dnia na dzień prowadzą jedynie do przejściowych zmian w mikrobiocie, rodzaj spożywanych przez nas pokarmów może mieć trwały wpływ na ekosystem trawienny5 i w dłuższej perspektywie prowadzić do dysbiozy. Badania sugerują, że dieta w stylu zachodnim, bogata w tłuszcze, cukier i białko, może sprzyjać zaburzeniu równowagi mikrobioty jelitowej, podczas gdy zróżnicowana dieta bogata w owoce i warzywa może ją chronić.1,19
Antybiotyki
Ocaliły miliony osób, ale ich nadmierne i niewłaściwe stosowanie stanowi obecnie poważny problem dla zdrowia, szczególnie w zakresie oporności na antybiotyki i zaburzeń mikroflory jelitowej. Każdego roku WHO organizuje Światowy Tydzień Wiedzy o Antybiotykach (WAAW, ang. World Antibiotic Awareness Week), aby zwiększyć świadomość na temat oporności na środki przeciwdrobnoustrojowe. Obejrzyj stronę poświęconą tej tematyce.
Antybiotyki: jaki wpływ na mikrobiotę i nasze zdrowie?
Każdego roku od 2015 r. WHO organizuje Światowy Tydzień Wiedzy o Antybiotykach (WAAW, ang. World Antibiotic Awareness Week), którego celem jest zwiększanie świadomości dotyczącej globalnej oporności na leki przeciwdrobnoustrojowe.
Oporność na środki przeciwdrobnoustrojowe występuje, gdy bakterie, wirusy, pasożyty i grzyby zmieniają się na przestrzeni czasu i nie odpowiadają już na leki. W rezultacie lekooporności antybiotyki i inne leki przeciwdrobnoustrojowe stają się nieskuteczne, a wyleczenie zakażeń jest coraz trudniejsze lub niemożliwe, co zwiększa ryzyko rozprzestrzeniania się chorób, ich ciężkiego przebiegu oraz zgonu.
Niniejsza kampania, obchodzona w dniach 18–24 listopada, zachęca całe społeczeństwo, fachowy personel medyczny oraz decydentów do ostrożnego stosowania antybiotyków, leków przeciwwirusowych, przeciwgrzybiczych i przeciwpasożytniczych, aby zapobiec dalszemu wyłanianiu się oporności mikroorganizmów.
Każda mikrobiota ma swoją własną dysbiozę i patologie
Dysbioza: przyczyna czy konsekwencja choroby?
Liczne badania porównujące mikrobiotę osób zdrowych i chorych wykazały, że dysbioza jest związana z różnymi przewlekłymi patologiami: chorobami jelit, takimi jak zespół jelita drażliwego czy choroba Leśniowskiego-Crohna, ale także z otyłością, alergiami, astmą i niektórymi nowotworami1. Jednak czy to dysbioza powoduje chorobę, czy choroba powoduje dysbiozę? Odpowiedź nie jest oczywista, a próba jej znalezienia motywuje naukowców do prowadzenia aktualnych badań.
W celu zgłębienia problemu naukowcy zainicjowali w 2019 roku Homo symbiosus, projekt badawczy mający na celu lepsze zrozumienie, dlaczego i w jaki sposób tak wiele chorób przewlekłych jest związanych z dysbiozą jelitową. Wysunęli hipotezę, że „zjawiska takie jak dysbioza jelitowa, namnażanie się drobnoustrojów, stany zapalne i osłabienie ściany jelita” wzajemnie się napędzają10.
Dysbioza mikrobioty jelitowej ma związek z różnymi chorobami układu pokarmowego, ale także z zaburzeniami metabolicznymi22, alergicznymi23, a nawet psychicznymi24. Jednak ludzkie ciało jest również domem dla specyficznych ekosystemów mikrobiologicznych zlokalizowanych w skórze25, drogach moczowych26, pochwie27, jamie ustnej28 i płucach29, z których wszystkie mogą też stać się niezrównoważone i być związane z określonymi chorobami.
Jak przywrócić równowagę mikrobioty?
Zazwyczaj po epizodzie dysbiozy mikrobiota jest w stanie w naturalny sposób powrócić do początkowej równowagi (chociaż jej pierwotny skład nigdy nie zostaje w pełni przywrócony): mówi się, że jest ona „odporna”30. Czasami jednak ta „rebioza” lub powrót do równowagi mikrobiologicznej może zająć trochę czasu: na przykład nawet u zdrowej osoby dorosłej może to zająć sześć miesięcy po zażyciu antybiotyków31. Wreszcie, dysbioza może prowadzić do zaburzenia równowagi, które utrzymuje się przez długi czas bez możliwości pełnego powrotu do stanu pierwotnego, co jest szkodliwe dla zdrowia1.
Co robić w przypadku dysbiozy? Istnieje kilka różnych rozwiązań pozwalających przywrócić równowagę mikrobioty i odzyskać lepsze zdrowie.
Międzynarodowe Obserwatorium Mikrobioty
Probiotyki to: „żywe mikroorganizmy, które podawane w odpowiednich ilościach przynoszą gospodarzowi korzyści zdrowotne” 32,33. Polecamy stronę poświęconą probiotykom, ich działaniu, produkcji i doborowi, którą można odwiedzić tutaj. Poznaj naszą stronę internetową poświęconą probiotykom.
Pochodzące głównie z włókien pokarmowych (fruktooligosacharydy, galaktooligosacharydy, inulina itp.) prebiotyki są nieprzyswajalnymi substratami lub składnikami odżywczymi wykorzystywanymi przez mikroorganizmy mikrobioty, mającymi korzystny wpływ na nasze zdrowie.34,35 Więcej informacji na temat ich wpływu na mikrobiotę znajdziesz tutaj. Produkty łączące probiotyki i prebiotyki nazywane są symbiotykami.36,37
To, co jemy – zarówno jakość, jak i różnorodność naszej diety – przyczynia się do równowagi naszej mikrobioty jelitowej,38,39 a także wpływa na jej skład i może być odpowiedzialne za pojawienie się niektórych chorób.22 Zapytaj swojego lekarza rodzinnego i/lub dietetyka o porady dotyczące tego, które pokarmy mają korzystny lub szkodliwy wpływ, aby utrzymać jelita w jak najlepszej kondycji 40i zachować zdrowie!
Podobnie jak inne narządy, mikrobiota może zostać przeszczepiona innej osobie w celu przywrócenia równowagi jej ekosystemu mikrobiologicznego.41,42 Obecnie takie podejście terapeutyczne jest dobrze udokumentowane w odniesieniu do mikrobioty jelitowej, znane jako przeszczep mikrobioty kałowej (FMT), jednak obecnie jest ono dopuszczone jedynie w celu leczenia nawracających zakażeń Clostridioides difficile.41 Prowadzone są intensywne badania nad techniką przeszczepu FMT pod kątem innych patologii jelitowych.41 Obecnie testuje się również transplantację mikrobioty pochwy (VMT) która może być obiecującą opcją w leczeniu opornego lub nawracającego bakteryjnego zapalenia pochwy.43 Badania nad przeszczepem mikrobioty skóry są nadal nieliczne, pierwsze wyniki są jednak dość obiecujące.44,45

"Informacyjny" -Peggy Rhinelander (Od My health, my microbiota)
"Absolutnie fascynujące, jak dysbioza ujawnia ukryte powiązania między naszym zdrowiem a mikrobiotą!" -Aware Health Rewards App (Od My health, my microbiota)