jakie czynniki powodują nawroty choroby?
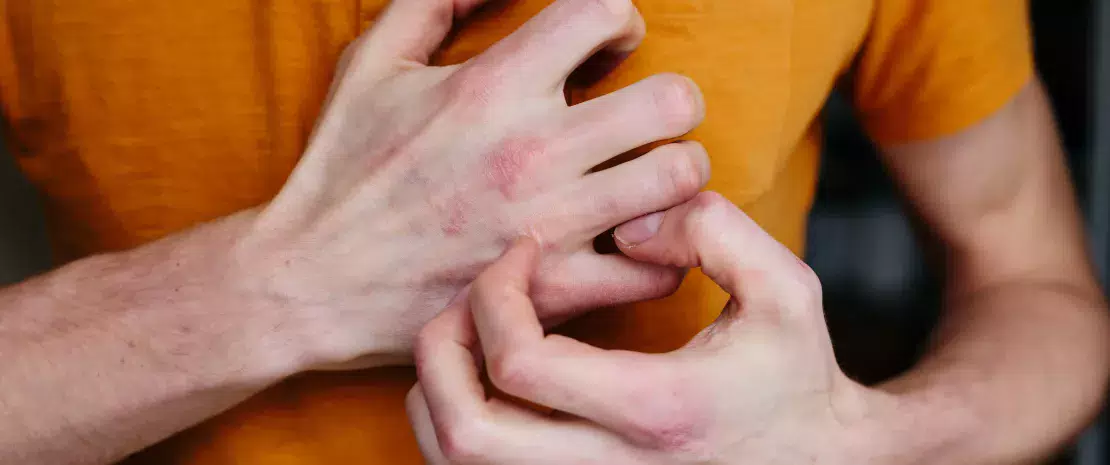
Powstawanie ognisk zapalnych może wynikać z różnych czynników, takich jak stres, zanieczyszczenie, zimno, wilgoć, niektóre alergeny (pyłki roślin), niektóre leki, wełniana odzież oraz niektóre kosmetyki zawierające rośliny lub olejki eteryczne.
Co wiemy o związkach między atopowym zapaleniem skóry, mikrobiotą a odpornością?
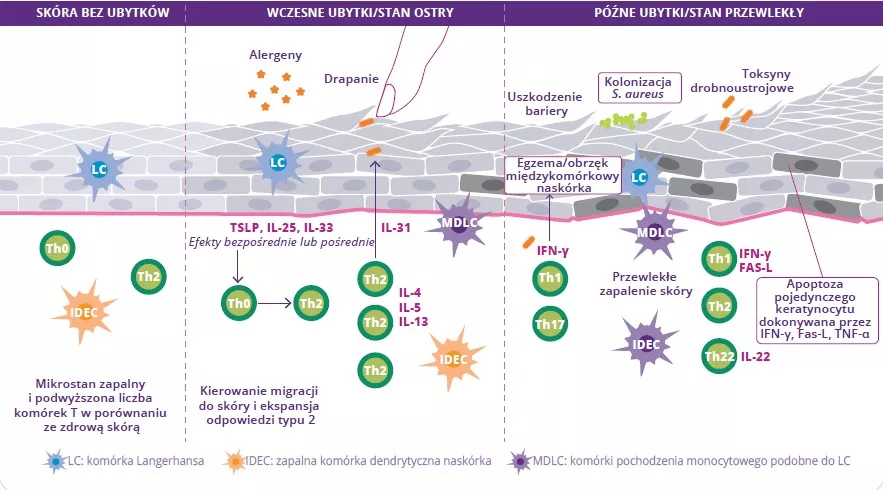
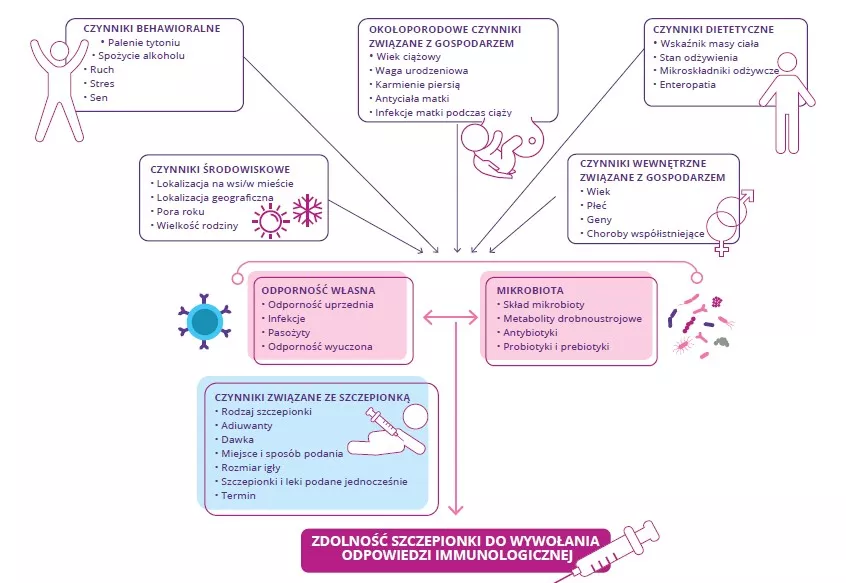
Pod względem patofizjologicznym AZS charakteryzuje się naruszeniem bariery skórnej, dysbiozą skóry i jelit oraz rozregulowaniem układu odpornościowego z pobudzeniem limfocytów Th2. To rozregulowanie układu odpornościowego prowadzi do pojawienia się dużej ilości cytokin, co z kolei powoduje reakcje zapalne.2
Naruszenie bariery skórnej jest początkiem dysbiozy mikrobioty skóry charakteryzującej się zmniejszeniem różnorodności bakterii i proliferacją Staphylococcus aureus. Penetracja alergenu prowadzi do pobudzenia keratynocytów i wytwarzania interleukin (IL-33, IL-25, TSLP), co powoduje różnicowanie limfocytów Th2. One z kolei wydzielają cytokiny prozapalne (IL-4, IL-5 i IL-13) charakterystyczne dla stanu zapalnego typu 2 (rys. 9). Cytokiny te bezpośrednio pobudzają nerwy czuciowe, co wywołuje swędzenie
Przewlekłe ubytki powodują, że bariera skórna odtwarza się w małym stopniu i staje się grubsza, ponieważ jest dotknięta przewlekłym stanem zapalnym. Występuje również stopniowy wzrost ilości cytokin i komórek Th (Th1, Th2, Th22) wydzielających cytokiny, które przyczyniają się do niszczenia keratynocytów. Dysbioza jelit również może grać rolę w patofizjologicznym mechanizmie choroby.3
Czego się pani nauczyła z ostatnich odkryć dotyczących mikrobioty? Czy wpłynęły one na pani praktykę?
Dzięki najnowszym odkryciom w zakresie mikrobioty lepiej rozumiem znaczenie utrzymywania i odtwarzana bariery skórnej w celu kontroli stanu zapalnego. Jako leczenie ogólnoustrojowe zalecam moim pacjentom stosowanie żelu do mycia chroniącego pH skóry (pH ~5, unikanie produktów o zasadowym pH), produktu nawilżającego oraz specjalnie dla nich przeznaczonych kosmetyków. Ustalenia te pomagają nam również lepiej poznać układ odpornościowy skóry i dowiedzieć się, jak chronić jej mikrobiotę.
Co pani myśli o stosowaniu probiotyków w leczeniu azs lub zapobieganiu nawrotom?
W przypadku AZS jest wiele sposobów równoważenia mikrobioty skóry (probiotyki, prebiotyki, symbiotyki itp.)5, ale najciekawsze wydają mi się postbiotyki. Postbiotyki to preparaty z organizmów nieożywionych i/lub ich składników korzystnie działające na gospodarza.6 Mogą one odtworzyć barierę skórną poprzez działanie przeciwzapalne umożliwiające bakteriom rekolonizację, mają zatem długofalowy wpływ na mikrobiotę. Probiotyki lub prebiotyki doustne to kolejna interesująca metoda regulacji układu jelitowego, który pełni ogólną funkcję immunomodulacyjną
w układzie odpornościowym.7