Oś jelito-płuca w wirusowych infekcjach dróg oddechowych
Dr Genelle Healey
Warto zauważyć, że – jak się wydaje – mikrobiota w obu tych organach ulega zaburzeniom podczas infekcji dróg oddechowych, co przemawia na korzyść teorii, że wszystkie narządy pokryte śluzem są ze sobą połączone i że oś jelito-płuca jest dwukierunkowa.1
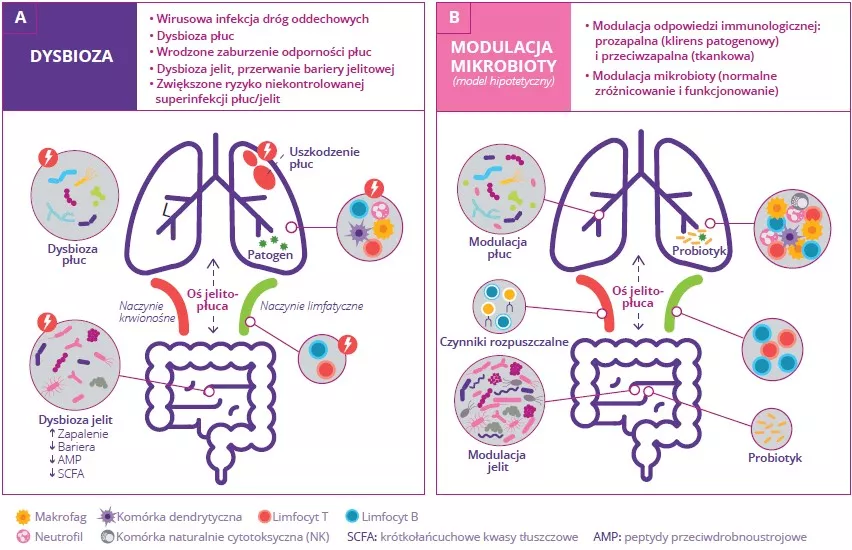
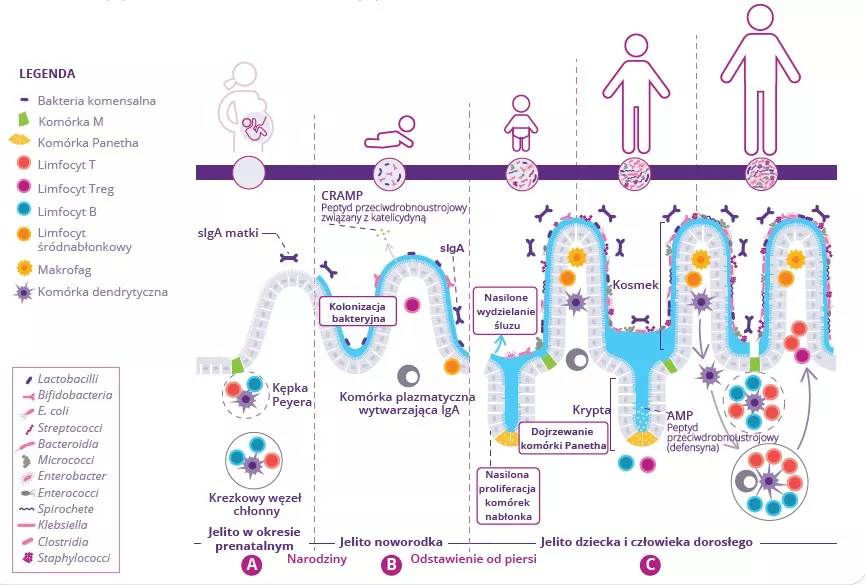
Bakterie jelitowe, ich fragmenty, a także SCFA mogą przenikać przez barierę jelitową, przemieszczać się w krezkowym układzie limfatycznym, wnikać do układu krążenia ogólnoustrojowego i modulować komórki układu odpornościowego w płucach.11 Podczas infekcji typu grypowego mikrobiota płuc i funkcjonowanie układu odpornościowego zostają zaburzone. Obserwuje się również dysbiozę mikrobioty jelit, co może tłumaczyć współistniejące często objawy przypominające wirusowe zakażenie przewodu pokarmowego (Fig 7A).10
RYSUNEK 7: Oś jelito-płuca podczas wirusowej infekcji dróg oddechowych (A) i model modulacji mikrobioty przy użyciu probiotyków (B).
Adaptacja na podstawie Dumas A et al, 20182
Probiotyki mogą pomóc w powrocie do zdrowia (homeostazy mikrobioty, kontroli infekcji, modulacji odpowiedzi immunologicznych) dzięki metabolitom mikrobioty jelit (SCFA i inne) lub produktom pochodzącym od gospodarza.
Dysbioza jelit może mieć kilka przyczyn, między innymi utratę apetytu (prowadzącą do przyjmowania mniejszej ilości pożywienia i kalorii) oraz wydzielanie cytokin zapalnych. Może to mieć miejscowe konsekwencje, takie jak stan zapalny jelit, przerwanie bariery jelitowej mniejsza ilość wytwarzanych peptydów przeciwdrobnoustrojowych (AMP), spadek ilości SCFA, potencjalnie prowadzące do wtórnych infekcji jelit.10
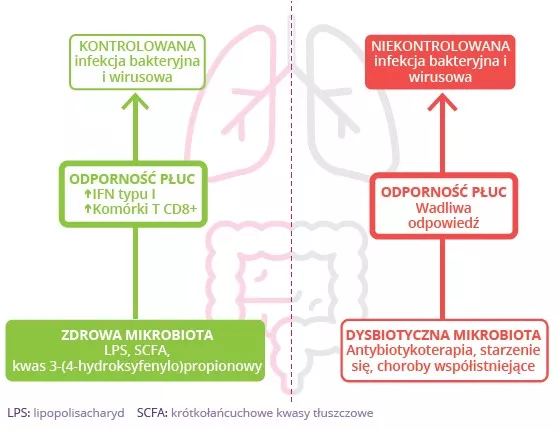
Zaburzenie bariery jelitowej sprzyja przenikaniu bakterii oraz wyzwalaniu endotoksyn do krwi, co prowadzi do ogólnoustrojowego stanu zapalnego, nasilenia uszkodzeń płuc i podwyższonego ryzyka wtórnych infekcji bakteryjnych.10 Ograniczenie wytwarzania SCFA przez mikrobiotę jelit również przyczynia się do obserwowanego w płucach zmniejszenia odporności na bakterie.10 Wskazuje to na istotną rolę mikrobioty jelit w obronie płuc przed infekcjami dróg oddechowych.
Modulacja mikrobioty jelit przy użyciu strategii takich jak probiotyki może pomóc w zmniejszeniu podatności na infekcje dróg oddechowych za pośrednictwem osi jelito-płuca albo w zwalczeniu infekcji i powrocie do zdrowia (rys. 7B). Kilka badań na myszach wykazało, że konkretne probiotyki podawane przed zakażeniem grypą powodowały mniejsze nagromadzenie komórek układu odpornościowego w zakażonych płucach. Probiotyki te poprawiały też klirens wirusowy i ogólny stan zdrowia, a także zmniejszały zaburzenia mikrobioty jelit.12,13
Polecane przez naszą społeczność

"Cóż, należę do osób cierpiących na problemy z płucami (infekcja)
Rozumiem, że to takie ważne." -@Ahishakiyejanv2 (Od Biocodex Microbiota Institute w X)