Microbiota vaginal #15
Por el Prof. Markku Voutilainen
Facultad de medicina de la Universidad de Turku; gastroenterología, Hospital Universitario de Turku, Finlandia



Por el Prof. Markku Voutilainen
Facultad de medicina de la Universidad de Turku; gastroenterología, Hospital Universitario de Turku, Finlandia

La predicción del riesgo de parto prematuro mediante un método sencillo, rápido y barato es un reto para los obstetras, que aún no disponen de un método predictivo fiable para esta complicación clínica, la principal causa de muerte en niños menores de cinco años. Los factores de riesgo son bien conocidos: disbiosis vaginal asociada a inflamación local.
Un equipo de investigadores tuvo la idea de utilizar su método de análisis DESI-MS (Espectrometría de masas de ionización por desorción de electrospray), recientemente descrito, para identificar —en menos de 3 minutos y sin necesidad de preparar una muestra— los metabolitos presentes en la mucosa cervicovaginal. ¿Cuáles eran sus hipótesis? Que el metaboloma caracterizado con este método puede permitir predecir la composición de la microbiota vaginal y las respuestas inmunitarias e inflamatorias locales, así como hacer un seguimiento de su evolución hacia estados asociados al riesgo de parto prematuro. Se utilizó el método DESI-MS para analizar más de 1000 muestras cervicovaginales de 365 mujeres embarazadas en dos grupos.
Entre los metabolitos detectados, 113 permitieron distinguir eficazmente dos tipos de microbiota: una reducida y otra dominada por lactobacilos, que son un marcador de buena salud vaginal. El perfil metabólico obtenido con el método DESI-MS también predijo los niveles de varios marcadores inmunitarios (IL-1β, IL-8, C3b/iC3b, IgG3, IgG2, MBL o lectina de unión a la manosa) medidos en un subgrupo de 319 mujeres. Se encontraron algunos de ellos (C3b, IL-1β, IgG2, IgG3) en niveles elevados en microbiomas vaginales con reducción de Lactobacillus, lo que indica la activación de una respuesta inmunitaria innata y adaptativa local. En una última serie de pruebas, el perfil metabólico vaginal obtenido mediante el método DESI-MS no consiguió predecir de forma fiable el riesgo directo de parto prematuro. Sin embargo, los investigadores prevén posibles aplicaciones clínicas. El seguimiento de los metabolitos vaginales mediante DESI-MS podría ayudar a detectar cambios en la microbiota vaginal y en los marcadores inmunitarios locales asociados al parto prematuro.
Por el Prof. Markku Voutilainen
Facultad de medicina de la Universidad de Turku; gastroenterología, Hospital Universitario de Turku, Finlandia
El cáncer de próstata (CP) es uno de los tumores malignos más habituales en los hombres. Dado que el crecimiento y el avance de los tumores dependen de los niveles de andrógenos, para tratar a pacientes con CP se utiliza un tratamiento de privación androgénica (TPA), castración química o quirúrgica. Sin embargo, algunos desarrollan un cáncer de próstata resistente a la castración (CPRC) que desemboca en una progresión tumoral, por lo que se están estudiando nuevas estrategias de tratamiento. Como hay estudios recientes que apuntan a la función de la microbiota tanto en la aparición del cáncer como en el éxito del tratamiento, los autores utilizaron modelos de ratones con CP y datos de pacientes para estudiar la función de la microbiota intestinal en la carcinogénesis del CP. Se observó un enriquecimiento de Ruminococcus spp. y de Bacteroides acidifaciens tras la aparición del CPRC, pero la ablación de la microbiota intestinal ralentizó el crecimiento del tumor en ratones con CPRC. El trasplante de microbiota fecal (TMF) de ratones resistentes a la castración (RC) y la administración de R. gnavus condujeron a un aumento de los niveles de andrógenos circulantes, al crecimiento del CP y a la aparición de CPRC. El crecimiento del CP se controló con un TMF de individuos con PC sensibles a las hormonas y la administración de Prevotella stercorea. En los pacientes con CPRC se observó un enriquecimiento de los géneros Ruminococcus y Bacteroides, asociado a un mal desenlace, mientras que los pacientes con CP sensibles a las hormonas presentaban una mayor abundancia del género Prevotella asociado a un desenlace más favorable.
La microbiota intestinal comensal en pacientes sometidos a privación androgénica y en ratones produce andrógenos que promueven la neoplasia del CP y la aparición de CPRC mediante la circulación general. La modulación de la microbiota intestinal podría teóricamente utilizarse como tratamiento complementario del CP.
La enfermedad pulmonar obstructiva crónica (EPOC) hace referencia a neumopatías (enfisema, bronquitis y asma) que se caracterizan por una disnea progresiva. Estudios recientes han descubierto cambios en la microbiota intestinal relacionados con la aparición de neumopatías. Aunque se considera primeramente una enfermedad respiratoria, la EPOC suele coincidir con enfermedades crónicas del tubo digestivo. En el estudio que nos ocupa, los autores se interesaron por el eje intestino-pulmón relacionado con la EPOC. Los análisis de heces revelaron que pacientes con EPOC grave tenían una menor abundancia de Bacteroidetes pero una mayor abundancia de Firmicutes. De entre las familias bacterianas, la abundancia de Prevotellaceae era superior en los casos de EPOC leve, mientras que la abundancia de Bacteroidaceae y Fusobacteriaceae era inferior en los casos de EPOC grave, en comparación con pacientes control sanos. Los niveles de ácidos grasos de cadena corta (AGCC) eran significativamente más bajos en la EPOC grave. El trasplante de microbiota fecal (TMF) de pacientes con EPOC a ratones provocó una reducción significativa del peso y una hipersecreción de moco en las vías respiratorias de los ratones. Se observó un deterioro acelerado de la función pulmonar en ratones con TMF durante una exposición al humo de biomasa. El estudio reveló que los pacientes con EPOC presentan una disbiosis de la microbiota intestinal con niveles reducidos de AGCC. Es posible que estos cambios estén relacionados con la inflamación de las vías respiratorias y la progresión de la EPOC.
Los inhibidores del punto de control inmunitario (IPCI) han mejorado notablemente el pronóstico de varios cánceres avanzados. Se ha demostrado que la microbiota intestinal puede modular la respuesta al tratamiento con IPCI, y que podría estar implicada en la patogénesis de reacciones adversas inmunomediadas (RAI). Aunque se sabe que los antibióticos empeoran el pronóstico de pacientes con cáncer tratados con IPCI, poco se conoce sobre el efecto en la microbiota de varios cotratamientos cuando se administran al inicio del tratamiento con IPCI. En el estudio que nos ocupa, los autores estudiaron el efecto de los medicamentos combinados suministrados 1 mes antes o después de la administración de IPCI en los resultados del tratamiento y la aparición de RAI.
El uso de antibióticos, glucocorticoides (dosis diaria > 10 mg), inhibidores de la bomba de protones, psicofármacos, morfina e insulina se asociaron a un periodo de supervivencia significativamente más corto y a una menor respuesta del tumor. Una terapia combinada de estos fármacos redujo la supervivencia más que la monoterapia. Estos medicamentos se asociaron además a una menor aparición de RAI. La coadministración de estatinas, inhibidores de la enzima convertidora de la angiotensina y/o antagonistas de los receptores de la angiotensina II, antiinflamatorios no esteroideos, aspirina y antidiabéticos orales no influyó en la supervivencia de los pacientes.
El estudio que nos ocupa demostró que los cotratamientos influyen tanto en la respuesta como en los RAI del tratamiento con IPCI. Se puede intervenir en el efecto de los comedicamentos mediante la microbiota u otros mecanismos inmunomoduladores. En la práctica clínica, se deberían evaluar minuciosamente los tratamientos combinados iniciales al planificar un tratamiento con IPCI. Siempre que sea posible, se deben evitar fármacos con efectos negativo en el tratamiento con IPCI.
De vuelta del congreso
Por el Prof. Eamonn M M Quigley
Lynda K y David M Underwood Centro de Trastornos Digestivos, Servicio de Gastroenterología y Hepatología, Hospital Metodista de Houston y Facultad de Medicina Weill Cornell, Houston, Texas, EE. UU

La celebración del WCOG 2020 se había previsto para finales de 2020 en Praga, la capital de la República Checa, pero hubo que posponerla debido a la pandemia de la COVID, y terminó celebrándose en formato híbrido del 9 al 11 de diciembre de 2021. Gracias a la diligencia y la capacidad de organización de todos los interesados, se desarrolló una excelente plataforma virtual que permitió la retransmisión a todo el mundo de simposios que trataron todas las facetas de la especialidad, charlas magistrales especiales, trabajos libres originales y pósteres. En estas sesiones, expertos de todo el mundo se unieron a profesores universitarios de la República Checa para abordar temas “candentes” y controvertidos por igual. Aquí nos centraremos en el microbioma intestinal.
Salud Digestiva, patrocinado por la Organización Mundial de Gastroenterología (WGO), fue “Microbioma intestinal: una perspectiva global”. Eamonn MM Quigley, en nombre de los numerosos colegas que contribuyeron a este programa, hizo un resumen con una visión general del microbioma intestinal. Fueron definidos los factores que afectan al microbioma y conforman su desarrollo durante ese período decisivo y vulnerable que abarca desde el nacimiento hasta la primera infancia, y se hizo hincapié en el papel de la alimentación a lo largo de la vida de la persona. Aunque se ha sugerido una influencia del microbioma en varios grados de la enfermedad, numerosos estudios han descrito una asociación, no una causalidad.
Una de las enfermedades en las que la función del microbioma ha generado mucha expectación es el síndrome del intestino irritable (SII). Mirjana Rajilic-Stojanovic exploró esta cuestión en detalle y señaló los factores que complican la interpretación de los estudios del microbioma en el SII (por ejemplo, un tamaño reducido de la población del estudio, una heterogeneidad del fenotipo, diseños variables de los estudios) que, sin duda, contribuyen a la falta de una firma microbiana homogénea para el SII. Nos alertó sobre dos organismos que pueden ser de especial interés: Methanobrevibacter smithii y Faecalibacterium prausnitzii; el primero por su producción de metano y el segundo por la función que desempeña al señalizar las células enterocromafines, lo que lleva a un aumento de la biosíntesis de serotonina, un neurotransmisor fundamental del sistema nervioso entérico y diana terapéutica de gran parte de la farmacología del SII.
El microbioma presenta un enorme potencial terapéutico. Francisco Guarner actualizó las directrices de la WGO sobre los probióticos y Pavel Drastich abordó el fascinante tema del trasplante de microbiota fecal (TMF). Contrastó la eficacia del TFM en la enfermedad relacionada con Clostridioides difficile con datos mucho más variados de otros estados de enfermedades. De entre estas, la colitis ulcerosa es la que ofrece los mejores datos (aunque se siguen considerando solo de calidad moderada). Aquí, la interpretación de los resultados se ve obstaculizada por los mismos factores que confunden en tantos estudios del TMF: variabilidad en la selección de la población, en los criterios de valoración y en el protocolo del estudio. Esto incluye variables tan discutibles como el uso de heces frescas frente a congeladas, la vía de administración (nasoyeyunal, mediante enema, cápsula colonoscópica o cápsula ingerida), el número de tratamientos (único o múltiple) y el origen del material (de donante único o combinado de múltiples donantes). Lo más fascinante fue la visión que ofreció sobre el futuro del TMF, para el que predijo una evolución desde el TMF tal y como lo conocemos actualmente (es decir, muestras de heces enteras) pasando por el desarrollo de combinaciones o consorcios específicos de microbios (un ámbito de frenética actividad científica y comercial) hasta la elaboración de compuestos activos biológica y terapéuticamente a partir de microbios. Mirjana Rajilic-Stojanovic desarrolló tanto las promesas como las limitaciones del TMF en el SII. Aquí, las variables de confusión aparecen claramente: un fenotipo muy heterogéneo con un amplio abanico de síntomas, de gravedad variable y que fluctúan con el tiempo; un entendimiento incompleto de la función del microbioma y, en el mejor de los casos, un concepto especulativo sobre cómo actúa el TMF. No es de extrañar que los resultados, hasta la fecha, sean tan variables.
Francisco Guarner dirigió una de las sesiones inaugurales del programa sobre un tema que he reservado para el final: la situación actual de la investigación sobre la microbiota. Como de costumbre, fue una ponencia reflexiva, perspicaz y muy oportuna, dado el impacto de la epidemia de COVID-19 y la crisis mundial de resistencia a los antibióticos. ¿Necesitamos más recordatorios sobre la importancia de los microbios que conviven con nosotros en este planeta? Volvió al tema global ilustrando la implicación de una mala alimentación en el riesgo de mortalidad mundial, pero señaló hábilmente que esta misma alimentación no solo empobrece a los humanos, sino también a sus microbios y en particular a los productores de butirato. Unos niveles bajos de diversidad microbiana intestinal se han relacionado con varias enfermedades, de entre las que destaca el asma infantil. De cara al futuro, subrayó que el enfoque taxonómico es inadecuado para estudiar el microbioma en estados de enfermedad e ilustró este argumento demostrando que en personas sanas la composición del microbioma intestinal es muy dinámica; ¡hasta el 90% de las cepas aparecen y desaparecen con el tiempo! Por ello, invitó a buscar un nuevo enfoque para la definición de los microbiomas normales frente a los anormales (o eubiosis frente a disbiosis, como algunos prefieren llamarlo) que se centre en la competencia funcional y la estabilidad ecológica (incorporando conceptos como la resistencia a los cambios estructurales de la comunidad a lo largo del tiempo y la resiliencia, la capacidad de volver rápidamente a la normalidad, por ejemplo, tras un tratamiento antibiótico). Son conceptos clave que reflejan el paso actual, de la simple recopilación de números, especies y cepas microbianas, a la descripción del potencial funcional mediante la metagenómica y la determinación de productos metabólicos a través de la metabolómica y la metatranscriptómica.
Artículo comentado - adulto
Por el Prof. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
A pesar de su éxito general, los inhibidores de puntos de control de los linfocitos T para el tratamiento del cáncer (inmunoterapia anticancerígena) solo son eficaces en una minoría de pacientes. Recientemente, se ha descubierto que la microbiota intestinal modula de forma decisiva la inmunidad anticancerígena y la respuesta al tratamiento. Aquí, los autores han asociado los miembros del orden de los Clostridiales de la microbiota intestinal a una carga tumoral más baja en los modelos murinos de cáncer colorrectal (CCR). Curiosamente, estas especies comensales también se encontraban significativamente reducidas en los pacientes que padecían CCR en comparación con los controles sanos. La administración por sonda gástrica de una mezcla de cuatro cepas de Clostridiales (CC4) en ratones permitió prevenir e incluso tratar con éxito el CCR, como tratamiento independiente. Este efecto dependía de la infiltración intratumoral y de la activación de los linfocitos T CD8+. La administración de una cepa única de Roseburia intestinalis o de Anaerostipes caccae fue aún más eficaz que la mezcla CC4. En una comparación directa, la suplementación con la mezcla CC4 superó a la terapia anti-PD-1 en modelos con ratones de CCR y d e melanoma. Estos resultados ofrecen una base preclínica sólida para explorar las bacterias intestinales como una nueva terapia independiente contra los tumores sólidos.
La microbiota intestinal desempeña una función fundamental en el desarrollo del sistema inmunitario y el mantenimiento de la homeostasis inmunitaria. La microbiota intestinal no influye solo en el sistema inmunitario a escala local, sino también a nivel sistémico, al mantener una respuesta inmunitaria equilibrada. Al igual que en un amplio abanico de enfermedades como la obesidad, las enfermedades inflamatorias crónicas del intestino, los trastornos neuropsiquiátricos y el cáncer colorrectal (CCR), en todas ellas está implicada una perturbación del equilibrio microbiano, es decir, una disbiosis.
El CCR, uno de los tumores malignos diagnosticados con mayor frecuencia, sigue siendo la principal causa de muerte relacionada con el cáncer en el mundo, con factores de riesgo asociados al estilo de vida (alimentación, tabaco, alcohol) o a la obesidad. Además, todos estos factores están íntimamente relacionados con las modificaciones de la microbiota intestinal sana.
Los pacientes que padecen CCR presentan una microbiota intestinal alterada, con un aumento de ciertos taxones como Bacteroides o Fusobacterium [2], además de una disminución de taxones bacterianos pertenecientes al orden de los Clostridiales, en comparación con personas sanas [3]. La gran mayoría de los tumores colorrectales presentan una baja inmunogenicidad y, por tanto, no responden a las inmunoterapias actuales de activación de los linfocitos T. De hecho, los anticuerpos monoclonales anti-PD-1, anti-PD-L1 y/o anti-CTLA4 solo son eficaces en un 4 a 5% de los tumores CCR, los que presentan un defecto en el sistema de reparación de malos apareamientos o una elevada inestabilidad de microsatélites [4]. Varios estudios recientes han demostrado que ciertos miembros de la microbiota intestinal son capaces de modular la eficacia de los tratamientos anticancerígenos [5, 6]. En el estudio que nos ocupa, los autores intentaron evaluar si un cóctel de 4 cepas bacterianas, específicamente asociado a una baja carga tumoral en un modelo experimental de CCR podría desencadenar una respuesta inmunitaria antitumoral eficaz.
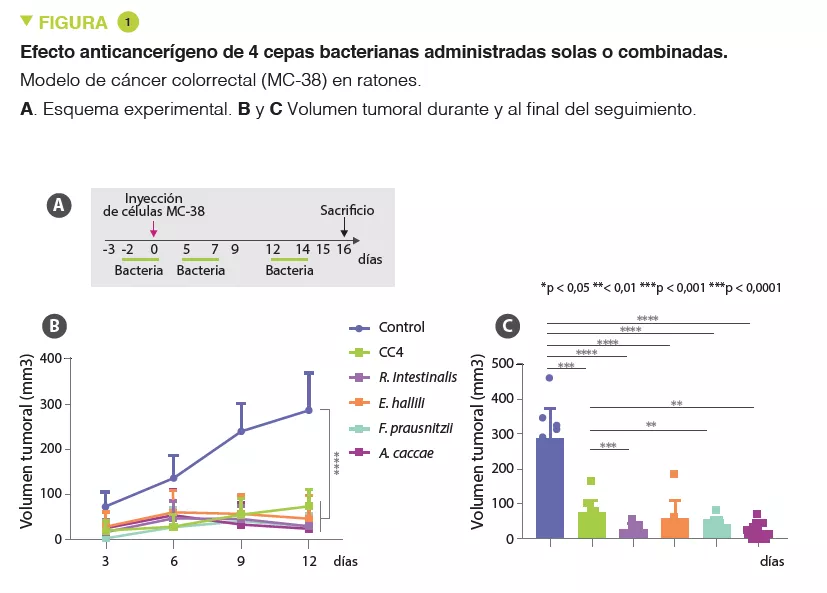
A partir de modelos animales, los autores han observado que los ratones con una microbiota pobre en bacterias del orden de los Clostridiales (familias Ruminococcaceae y Lachnospiraceae) presentaban mayor susceptibilidad al CCR. A partir de estos análisis y para realizar estudios más minuciosos en modelos con ratones, los autores seleccionaron una mezcla de estas cuatro especies de Clostridiales (CC4): Roseburia intestinalis, Eubacterium hallii (Anaerobutyricum hallii), Faecalibacterium prausnitzii y Anaerostipes caccae, cuya abundancia se encuentra reducida en los pacientes con CCR. La administración de CC4 tuvo repercusiones en la microbiota de los ratones, en concreto, un aumento de las especies pertenecientes a las familias Ruminococcaceae y Lachnospiraceae. En varios modelos de cáncer sólido, como el CCR, el de pulmón y el de mama, la administración de CC4 tenía como efecto ralentizar el crecimiento tumoral. Este beneficio estaba causado en gran medida por los linfocitos, ya que desaparecía en ratones desprovistos de linfocitos maduros (ratones Rag2 KO). Los principales candidatos son los linfocitos T CD8+ citotóxicos productores de interferón γ que infiltran masivamente el tumor en los animales que reciben CC4. El efecto protector también se observó individualmente con cada una de las cepas bacterianas y se probó en un modelo de CCR, pero con un grado de eficacia variable (Figura 1). El efecto terapéutico no estaba relacionado con la producción de butirato de las bacterias. Por último, en el modelo de CCR (MR-38) el cóctel CC4 tuvo un efecto superior a la inmunoterapia por anti-PD-1. Además, no se observó efecto aditivo alguno en los ratones que habían recibido la inmunoterapia y las 4 bacterias.
This study has shown that in addition to having an adjuvant role in the immunotherapy treatment of cancer, some microbiota bacteria exert their own anti-cancer effect in solid tumour mouse models. These results pave the way to the development of cancer treatments in man based on gut microbiota. These therapies could be used alone or in combination with other “conventional” anti-cancer treatments. However, the patient groups that would benefit most from this type of therapeutic approach are yet to be determined.
Este estudio en ratones muestra que las cepas bacterianas del orden de los Clostridiales, que están significativamente reducidas en los pacientes con cáncer colorrectal, son eficaces para estimular una respuesta anticancerígena frente a los tumores sólidos. Los mecanismos pasan por la activación de los linfocitos T CD8+, y son independientes de la inmunoterapia con anti-PD-1.
Síntesis
Por la Prof. Conceição Calhau
Escuela de Medicina NOVA, Universidad Nueva de Lisboa, Portugal
Por el Prof. Pedro Povoa
Escuela de Medicina NOVA, Nueva Universidad de Lisboa, Portugal; Unidad de Cuidados Intensivos Polivalentes, Hospital São Francisco Xavier, CHLO, Lisboa, Portugal; Centro de Epidemiología Clínica, OUH Odense, Hospital Universitario, Dinamarca

Por primera vez, se ha señalado la diversidad de la microbiota intestinal como un biomarcador del pronóstico de la gravedad de la COVID-19. Esto significa que los cambios en la microbiota como biomarcadores fiables en el contexto de la COVID-19 son una pieza clave en el puzle de la enfermedad, y subrayan la prioridad clínica de la prevención y la posibilidad de nuevas estrategias terapéuticas. En el 2020, el nuevo coronavirus afectó gravemente a determinados grupos de población, en concreto, a los mayores, así como a las personas con obesidad, hipertensión y diabetes [1]. Curiosamente, ciertas publicaciones han demostrado que la disbiosis es un factor común en todos estos pacientes [2, 3].
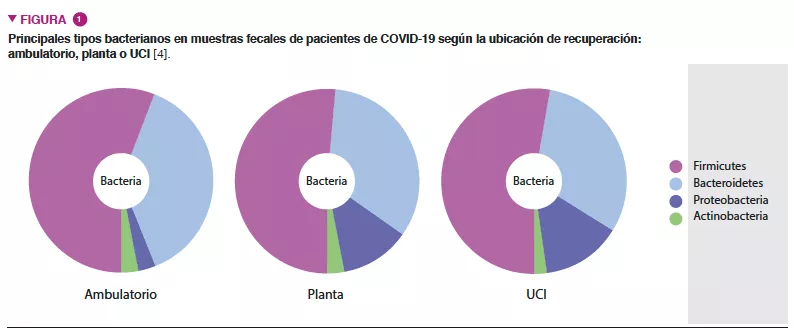
Dado que la comunidad científica ha considerado a la microbiota intestinal un asunto candente por su influencia determinante en las funciones inmunitarias e inflamatorias del anfitrión, decidimos investigar si cambios en la composición de la microbiota intestinal se asociaban a una mayor gravedad clínica de la COVID-19 [4]. Se realizó un estudio multicéntrico transversal en 115 pacientes con COVID-19 clasificados según: 1) lugar de recuperación de la COVID-19: ambulatorio (aislamiento domiciliario), en planta o en UCI; y 2) escala de gravedad de COVID-19: asintomática, de leve a moderada o grave. Los pacientes más enfermos presentaron cambios profundos en la composición de la microbiota intestinal, comparados con los pacientes de intensidad leve a moderada en régimen ambulatorio o ingresados en planta (Figura 1). Estos cambios incluían: 1) una menor diversidad microbiana intestinal general; 2) una menor abundancia de bacterias beneficiosas productoras de butirato como Roseburia y Lachnospira; 3) una menor proporción de Firmicutes/ Bacteroidetes; 4) una mayor abundancia de Proteobacterias. Además, detectamos el virus en muestras fecales, hecho que debe tenerse en cuenta en las recomendaciones de salud pública [5, 6]. Las publicaciones de otros colegas han demostrado que una baja diversidad podría ser un biomarcador clínico que predijese un mayor riesgo de gravedad [7-9].
La opinión generalizada era que unos pulmones sanos eran estériles. Sin embargo, en la última década, la aplicación de técnicas de investigación de la microbiota ha demostrado fehacientemente que no es así. Los pulmones son colonizados por una carga bacteriana muy baja, en comparación con el intestino [10]. Las distintas vías respiratorias, pulmones) presentan una diversidad y composiciones diferentes relacionadas con las fuentes de colonización, las tasas de colonización, las tasas de extinción y las distancias entre sí, según un modelo adaptado de isla, en el que la cavidad bucal es “tierra firme” [11]. Estudios recientes en pacientes graves de COVID-19 han demostrado una disbiosis de la microbiota de las vías respiratorias (analizada en muestras de LLBA) similar a la disbiosis observada durante infecciones del aparato respiratorio, como la neumonía [12, 13]. Además, Acinetobacter —un bacilo gramnegativo no fermentador frecuente en la neumonía asociada al respirador, que es la infección más grave adquirida en la UCI en pacientes sometidos a ventilación mecánica invasiva— era un género bacteriano que se encontró frecuentemente en tejidos pulmonares de pacientes fallecidos [14]. La presencia de algunos patógenos en el pulmón de pacientes fallecidos, así como en la cavidad bucal, está relacionada con la migración del modelo adaptado de isla. [15] Como resultado de la desregulación inmunitaria asociada a la COVID-19, numerosos estudios epidemiológicos han descubierto un mayor riesgo de infecciones adquiridas en el hospital, en concreto neumonía asociada al respirador, como observó nuestro equipo de investigación. En nuestro estudio descubrimos que los pacientes con COVID-19 presentaban el doble de riesgo de neumonía asociada al respirador comparados con pacientes sin COVID-19 [16].
Los estudios sobre la microbiota y el Covid-19 pueden abrir perspectivas para el desarrollo de opciones terapéuticas (probióticos, prebióticos...) cuyo objetivo es corregir la disbiosis observada en pacientes graves de COVID-19. Se espera que estas terapias aumenten la diversidad bacteriana general, así como la abundancia de bacterias comensales, contribuyendo de esta manera a inhibir la proliferación de patógenos oportunistas. Estos estudios también podrían tener implicaciones en el diseño de vacunas efectivas contra la COVID-19, ya que un factor conocido por controlar la eficacia de la vacuna podría ser la microbiota intestinal.
Síntesis
Por el Dr. Vincent Trebossen
Servicio de Psiquiatría Infantil y Adolescente, Hospital Robert-Debré, APHP, París, Francia
Por el Dr. Pierre Ellul
Servicio de Psiquiatría Infantil y Adolescente, Hospital Robert-Debré, APHP, Inmunología-Inmunopatología- Inmunoterapia, Hospital Pitié Salpêtrière, U959 INSERM, París, Francia
Por el Dr. Alexis Mosca
Servicio de Gastroenterología Pediátrica, Hospital Robert-Debré, APHP, París, Francia
Por el Prof. Richard Delorme
Servicio de Psiquiatría Infantil y Adolescente, Hospital Robert-Debré, APHP, Genética humana y funciones cognitivas, Instituto Pasteur, UMR3571 CNRS, Universidad de París, París, Francia

Los trastornos del espectro autista (TEA) son trastornos complejos del desarrollo neurológico que afectan a 1% de la población general y se caracterizan por carencias en la comunicación social y comportamientos repetitivos/estereotipados. Los mecanismos fisiopatológicos subyacentes al TEA son aún poco conocidos [1]. Entre el 30 y el 50% de las personas con TEA presentan síntomas gastrointestinales (GI) como dolor abdominal, diarrea o estreñimiento, que perjudican su calidad de vida y su funcionamiento general. Curiosamente, la aparición y gravedad de los síntomas gastrointestinales están fuertemente correlacionadas con los síntomas autistas [2]. Aunque aún se desconoce la etiología de los síntomas GI, varios estudios sugieren que el TEA pueden ser el resultado de un desequilibrio en la composición de la microbiota intestinal (MI) [3]. Varios hallazgos fiables indican importantes interacciones entre la MI y el sistema nervioso central (SNC). La MI afecta directamente el desarrollo neurológico, ya que influye en la neurogénesis, la supervivencia de las neuronas, el crecimiento del cerebro y la mielinización. Se ha observado que la modulación de la MI con pro- o prebióticos o el tra splante de microbiota fecal (TMF) en personas con TEA tiene efectos beneficiosos y a largo plazo en los síntomas GI y en los principales síntomas de autismo. Sin embargo, es necesario realizar ensayos aleatorios con doble ciego más amplios para confirmar la eficacia de las terapias con microbios en el TEA, específicamente, en la etapa temprana y crítica del desarrollo neurológico.
La microbiota intestinal humana (MI) está formada por aproximadamente 1013 microorganismos, principalmente bacterias, hongos y virus. La MI desempeña una función primordial en la salud humana, garantizando la función barrera del intestino, la modulación de la respuesta inmunitaria y la síntesis metabólica, pero también una protección directa frente a infecciones. La disbiosis caracterizada por una MI desequilibrada se ha asociado con numerosas patologías como las enfermedades inflamatorias del intestino, tumores, diabetes u obesidad [4]. Varios hallazgos fiables indican además importantes interacciones entre la MI y el sistema nervioso central (SNC) [5] (Figura 1).
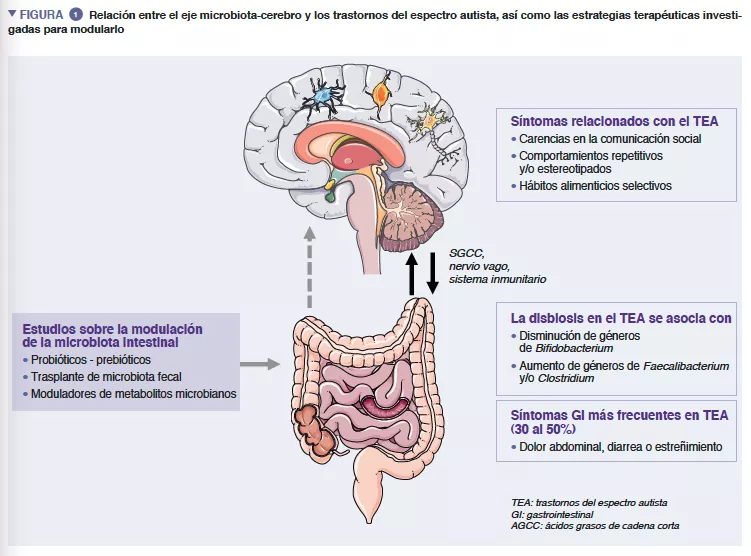
Los metabolitos microbianos (principalmente los ácidos grasos de cadena corta) y los moduladores inmunitarios son los mediadores de la interacción recíproca entre el cerebro y la MI, atravesando directamente las barreras hematoencefálica y sanguínea, e indirectamente, mediante la estimulación del nervio vago [6]. Las pruebas respaldan la implicación de la MI en la regulación tanto del comportamiento humano como de las funciones intelectuales —en concreto, de las habilidades sociocomunicativas— aunque el mecanismo exacto aún se desconoce [5].
Los TEA son trastornos del desarrollo neurológico caracterizados por alteraciones en la comunicación social, en las interacciones sociales, por comportamientos repetitivos o estereotipados, que se inician en la infancia y afectan aproximadamente a 1% de la población general. El determinismo del TEA se debe principalmente a factores genéticos, con una heredabilidad estimada que llega al 0,8-0,9, pero las circunstancias ambientales prenatales y postnatales pueden actuar como factores precipitantes o moduladores de la gravedad de los síntomas. La etapa del desarrollo del cerebro en un momento temprano de la vida se solapa con la de la MI. Esta empieza a desarrollarse poco después del nacimiento, y su composición se estabiliza en un perfil similar al de un adulto en torno a los 3 años. En la composición temprana de la MI influyen en gran medida factores ambientales tales como el lugar de nacimiento, el modo de parto, la lactancia materna y los xenobióticos (por ejemplo, la administración de antibióticos).
Los ratones axénicos son un modelo que carece de cualquier tipo de microorganismo, es decir, son microbiológicamente axénicos (no se pueden cultivar microorganismos que provengan de ratones axénicos). Los modelos murinos axénicos son valiosos para descifrar los mecanismos subyacentes de las funciones de la MI en el desarrollo neurológico, pero también en la relación entre microbioma y enfermedad. Varios estudios demostraron que los ratones axénicos presentan (i) un defecto en la permeabilidad de la barrera hematoencefálica; (ii) un mayor volumen cerebral; (iii) una mayor expresión genética de la microglía inmadura y una menor capacidad de respuesta inmunitaria de la microglía; (iv) un aumento de la mielinización; y (v) una disminución de la expresión del factor neurotrófico derivado del cerebro y en una subunidad de los receptores de N-metil-D-aspartato [5, 7] Todos estos datos destacan la función de la MI en la formación y la integridad de la barrera hematoencefálica, la neurogénesis, la homeostasis de la microglía, la mielinización y el crecimiento y la función del cerebro.
Los ratones axénicos mostraron comportamientos de tipo autista, como evitación social, comportamientos repetitivos o estereotipados, falta de interés en la actualidad social. Algunos de estos comportamientos desaparecieron tras la colonización con una MI de ratones silvestres, mientras que la colonización con MI de modelos murinos con TEA aumentó dichos comportamientos. Efectivamente, parece que la MI es fundamental para la programación y presentación de las habilidades sociales y los comportamientos adaptativos [8].
Cada vez hay más pruebas que demuestran que los síntomas GI están sobrerrepresentados en los niños con TEA. Los síntomas GI como el dolor abdominal, el estreñimiento y la diarrea, aparecen en casi el 30-50% de los pacientes con TEA y afectan en gran medida en la calidad de vida de los niños [1]. La gravedad de los síntomas gastrointestinales se correlacionó con la gravedad de los síntomas autistas, y la disbiosis intestinal está ampliamente documentada, incluso aunque aún no exista una firma microbiana específica relacionada con los síntomas autistas. Los estudios que exploran la MI han descrito diferencias en la diversidad de la microbiota, así como patrones anormales de metabolitos, en comparación con pacientes de control sanos. Dos metanálisis recientes que exploraron la composición de la MI en pacientes con TEA observaron un descenso de los géneros Bifidobacterium y un aumento de Faecalibacterium y Clostridium en pacientes con TEA [9, 10] en comparación con los controles sanos. La exploración del metaboloma fecal también demostró un aumento de p-cresol, un metabolito bacteriano derivado de la tirosina, en personas con TEA. En su conjunto, todos estos datos pueden indicar una posible asociación entre las anomalías de la MI y los síntomas GI en pacientes con TEA.
Sin embargo, la mayoría de los estudios tienen resultados heterogéneos y limitaciones metodológicas. Factores de confusión como son distintos países con distintos estilos de vida y hábitos alimenticios son los mayores inconvenientes de estos estudios. De hecho, un estudio reciente de una gran muestra de 247 personas con TEA no describió vínculos directos entre el diagnóstico del TEA o síntomas autistas y la disbiosis de la MI. La disbiosis se asociaba a una alimentación menos diversificada, un factor común de los pacientes con TEA [8].
Casi el 30-50% de los pacientes con TEA notificaron síntomas como dolor abdominal, diarrea y estreñimiento. La disbiosis de la MI en pacientes con TEA ha sido suficientemente explorada y confirmada a través de metanálisis, a pesar de que no exista una firma específica del microbioma [9, 10]. La relación entre la disbiosis de la MI y el TEA sigue siendo poco conocida. Algunos estudios sugieren vínculos directos a través del eje microbiota intestinal-cerebro que influye en los síntomas autistas y en los síntomas gastrointestinales. Más recientemente, un estudio ha sugerido que la disbiosis de la MI en pacientes con TEA está relacionada principalmente con una dieta restrictiva, lo cual es frecuente en pacientes con TEA [8].
Un número cada vez mayor de estudios ha explorado la posible repercusión de estrategias terapéuticas basadas en la microbiota para mejorar los síntomas GI y los síntomas principales en personas con TEA.
En el TEA se han utilizado probióticos (microorganismos vivos) que podrían tener un efecto beneficioso en pacientes con este trastorno. Algunos estudios preclínicos han notificado un aumento de las interacciones sociales tras una suplementación con probióticos (Bacteroides fragilis NCTC9343, Lactobacillus reuteri MM4-1A) en modelos murinos con TEA. La mejora de la comunicación social se relacionó con una mayor expresión de oxitocina en el SNC. En humanos, numerosos estudios han descrito efectos positivos de los tratamientos con probióticos en la composición de la MI y en los síntomas GI en el TEA [11]. Sin embargo, pocos han notificado una mejoría de los síntomas autistas principales. En la mayoría de los ensayos clínicos que suministraron probióticos a personas con autismo se observó una falta de uniformidad en cuanto a los probióticos, a la posología diaria o total, y la duración de todo el tratamiento. Aunque algunos estudios sugieren que los probióticos podrían ser interesantes para prevenir los síntomas GI en pacientes con TEA, es necesario replicar los resultados para garantizar el efecto positivo de dicha estrategia. De la misma manera, se ha explorado la eficacia de los prebióticos, como el galactoligosacárido (GOS) o el fructoligosacárido en el TEA [12]. Se observó una alteración de la MI y una disminución del interés social en ratones con estrés crónico. Utilizando este modelo murino, se asoció la administración de prebióticos a un aumento de las interacciones sociales en estos ratones. En humanos, se ha observado que el consumo de GOS asociado a una alimentación sin caseína ni gluten, mejoraba los síntomas GI y las interacciones sociales, junto con un aumento de la abundancia de Bifidobacterium en la MI. Es necesario realizar estudios clínicos aleatorizados con doble ciego para confirmar estos hallazgos preliminares.
También se ha estudiado el trasplante de microbiota fecal (TMF) en el TEA. El TMF consiste en realizar un trasplante de MI de un donante para modificar la MI del receptor. Actualmente, su eficacia en la infección por Clostridioides difficile está suficientemente demostrada, incluso en niños. Un reciente ensayo clínico exploratorio no aleatorizado y sin doble ciego, en el que participaron 18 niños diagnosticados de TEA y con síntomas GI, evaluó el efecto de la terapia de transferencia de microbiota (TTM), un protocolo modificado del TMF [13]. La TTM consistía en un tratamiento de dos semanas con antibióticos, un lavado intestinal, antes de recibir el tratamiento con TTM que consistía en una dosis elevada por vía oral o rectal seguida de una dosis oral de mantenimiento durante 7 u 8 semanas. Se observaron acontecimientos adversos al comienzo del tratamiento con vancomicina (comportamientos perturbadores, hipercinesia), que desaparecieron espontáneamente tras 3 días de tratamiento. El protocolo de la TTM condujo a una mejoría significativa de los síntomas GI tras el consiguiente estudio de 8 semanas. De manera aún más sorprendente, también se observó una mejoría en los síntomas autistas principales (comportamientos estereotipados y repetitivos, habilidades de comunicación social) 8 semanas después de la TTM. Curiosamente, la mejoría de los síntomas GI y de los síntomas autistas perduró 2 años después del tratamiento y se relacionó con el aumento de la diversidad de la MI [14]. Dos años después de la TTM, la reducción media de la puntuación total de la escala de evaluación de síntomas gastrointestinales (GSRS) seguía siendo superior al 50%. Los cambios en los síntomas autistas medidos con la escala de evaluación del autismo infantil (CARS), la escala de sensibilidad social (SRS) o la lista de comprobación del comportamiento autista (ABC) se relacionaron positivamente con los cambios porcentuales en las puntuaciones de la GSRS. Estos resultados aún no se han confirmado con estudios aleatorizados con doble ciego y en comparación con placebo.
Recientemente, un ensayo clínico experimental abierto sobre el TEA ha explorado el efecto de un adsorbente oral con restricción GI (AB-2004) que modula varios metabolitos de la MI. Los autores describieron una disminución de los comportamientos ansiosos en ratones, impulsada por una disminución de los metabolitos de la microbiota intestinal [15]. El estudio presentó además los resultados de un ensayo clínico en el que se administró una dosis de AB-2004 ajustada al peso a 30 adolescentes con TEA durante 8 semanas. En la semana 8, se observaron niveles reducidos de metabolitos de MI en plasma y orina. Lo más interesante es que, después del tratamiento, hubo menos pacientes con síntomas gastrointestinales, pero también con menos comportamientos asociados al TEA, ansiedad e irritabilidad. Además, hubo un efecto remanente con una persistencia de la eficacia 4 semanas después de la interrupción del tratamiento [15]. Aún hay que determinar los factores que relacionan las mejorías clínicas y la administración de AB-2004, puesto que no se han estudiado ciertos factores indirectos, como el efecto de AB-2004 en cambios de la alimentación, el estado inmunitario o la función gastrointestinal. Es necesaria la realización de estudios más amplios, con doble ciego y comparativos con placebo, para seguir diseccionando el papel del AB-2004 en la comunicación social en humanos. En un contexto de falta de tratamiento específico para los síntomas GI y los síntomas autistas en pacientes con TEA, es necesario encontrar nuevas estrategias terapéuticas bien toleradas dirigidas a la MI o a los metabolitos microbianos, como el TMF/TTM, en particular en las etapas tempranas y críticas del desarrollo cerebral durante la infancia.mental abierto sobre el TEA ha explorado el efecto de un adsorbente oral con restricción GI (AB-2004) que modula varios metabolitos de la MI. Los autores describieron una disminución de los comportamientos ansiosos en ratones, impulsada por una disminución de los metabolitos de la microbiota intestinal [15]. El estudio presentó además los resultados de un ensayo clínico en el que se administró una dosis de AB-2004 ajustada al peso a 30 adolescentes con TEA durante 8 semanas. En la semana 8, se observaron niveles reducidos de metabolitos de MI en plasma y orina. Lo más interesante es que, después del tratamiento, hubo menos pacientes con síntomas gastrointestinales, pero también con menos comportamientos asociados al TEA, ansiedad e irritabilidad. Además, hubo un efecto remanente con una persistencia de la eficacia 4 semanas después de la interrupción del tratamiento [15]. Aún hay que determinar los factores que relacionan las mejorías clínicas y la administración de AB-2004, puesto que no se han estudiado ciertos factores indirectos, como el efecto de AB-2004 en cambios de la alimentación, el estado inmunitario o la función gastrointestinal. Es necesaria la realización de estudios más amplios, con doble ciego y comparativos con placebo, para seguir diseccionando el papel del AB-2004 en la comunicación social en humanos.
En un contexto de falta de tratamiento específico para los síntomas GI y los síntomas autistas en pacientes con TEA, es necesario encontrar nuevas estrategias terapéuticas bien toleradas dirigidas a la MI o a los metabolitos microbianos, como el TMF/TTM, en particular en las etapas tempranas y críticas del desarrollo cerebral durante la infancia.
El TMF es una nueva y eficaz forma de modular la MI, que se utiliza en enfermedades gastrointestinales y endocrinas. El trasplante de microbiota fecal (TMF) podría representar una nueva y eficaz oportunidad para modular/restablecer la MI en el TEA. Utilizando modelos con ratones en el TEA, el TMF mejoró eficazmente los síntomas principales del autismo, como carencias en la comunicación social y comportamientos estereotipados. En humanos, un ensayo experimental en adultos con TEA sugirió que el TMF podría mejorar no sólo los síntomas gastrointestinales, sino también la reciprocidad social y los comportamientos estereotipados. Hubo un efecto remanente con una persistencia de la eficacia 2 años después de la interrupción del tratamiento. Curiosamente, la eficacia se asoció a un aumento de la diversidad de la MI.El TMF podría ser una nueva estrategia terapéutica de vanguardia para tratar los síntomas gastrointestinales y conductuales de niños con TEA, e incluso para abrir nuevas vías hacia la fisiología de la comunicación social en los seres humanos.

El impacto de la microbiota intestinal en la trayectoria del desarrollo neurológico de los niños sigue estando inexplorado en gran medida. En este momento, no existen estudios que exploren el impacto de la modulación de la microbiota intestinal en la fase temprana del desarrollo del niño, especialmente en las habilidades de comunicación social. Estudios preliminares en adultos y niños han demostrado que la modulación de la MI conduce a una mejora de los síntomas gastrointestinales y de los comportamientos autistas. A partir de estos datos, realizaremos un ensayo clínico con doble ciego en niños pequeños con TEA en una fase muy temprana de su desarrollo cognitivo (antes de los 6 años). Nuestro objetivo es entender si el TMF realizado en un periodo crítico del desarrollo dará lugar a una mejoría significativa a largo plazo en la trayectoria de desarrollo del niño.
Los ácidos grasos de cadena corta (AGCC) son metabolitos de la microbiota intestinal cuya implicación en la enfermedad de Parkinson ya se sospechaba, sobre todo en los roedores. ¿Qué ocurre en el ser humano?
Cada año, el (sidenote: https://parkinsonscare.org.uk/worldparkinsonsday/ ) (11 de abril) es una ocasión para que las asociaciones de pacientes y los profesionales de la salud revisen los avances de la investigación sobre esta enfermedad neurodegenerativa compleja y todavía sin tratamiento. Sin duda, este año se hablará de un nuevo estudio realizado por un equipo de investigadores taiwaneses. Este equipo pretendía determinar si los AGCC permiten diferenciar a los pacientes de Parkinson de los individuos sanos y si existe una correlación con la gravedad de la enfermedad. Para ello, analizaron los niveles plasmáticos y fecales de varios subtipos de AGCC, así como la microbiota intestinal de 181 participantes (96 pacientes y 85 controles). Paralelamente, estudiaron el impacto motor y cognitivo de la enfermedad. Los resultados del estudio se publicaron en Neurology a principios de 2022.
En los pacientes de Parkinson, los resultados mostraron unos niveles fecales de AGCC (ácido butírico, ácido valérico y ácido propiónico) reducidos, mientras que los niveles plasmáticos estaban aumentados con respecto a los individuos sanos.
También se observó que las cantidades fecales de estos mismos AGCC eran bajos en los pacientes de Parkinson en un estadio avanzado en comparación con los pacientes que se encontraban en un estadio precoz de la enfermedad.
Las mediciones de la concentración fecal y plasmática varían según la gravedad de los síntomas motores y cognitivos.
Una afectación motora más grave se correlaciona con una baja concentración fecal de la mayoría de los AGCC y se asocia a una concentración plasmática aumentada de ácido propiónico.
Los síntomas cognitivos más importantes, por su parte, se asocian a una baja concentración de ácido butírico en las heces, así como a concentraciones plasmáticas de ácido butírico y valérico más elevadas.
El estudio muestra que la diversidad de la microbiota de los pacientes parkinsonianos es diferente de la de las personas sanas. Este estudio pone de manifiesto el hecho de que las concentraciones de AGCC se correlacionan con la cantidad de bacterias proinflamatorias (Clostridiales y Ruminococcus), en especial el ácido propiónico. Esto apoya la hipótesis de que la inflamación intestinal se asocia positivamente al empeoramiento de la enfermedad.
En concreto, estos resultados sugieren que los AGCC pueden servir de biomarcadores intestinales de la enfermedad de Parkinson y también reflejan su gravedad. Un avance científico interesante que permitiría un diagnóstico más preciso y un mejor tratamiento de los pacientes.
 Microbioma intestinal y procesos neurodegenerativ
Microbioma intestinal y procesos neurodegenerativ
Contrariamente a lo que se cree, la obesidad no se debe solo a los excesos. La carencia de vitamina B8 (biotina) puede desencadenar un círculo vicioso entre las bacterias intestinales y el paciente obeso. Explicación.

Las vitaminas, aunque son necesarias en cantidades muy pequeñas, no dejan de ser fundamentales para la salud; una carencia de vitamina C produce el escorbuto, del que murieron tantos marineros, cuando un limón habría podido salvarlos. En menor medida, los trastornos cognitivos, el embotamiento o también un estado de fatiga persistente podrían indicar una carencia de vitamina B. Por otra parte, esta «función vital» de la vitamina se refleja en su etimología: «vitamina» procede del latín vita, que significa 'vida'.
Entre las numerosas vitaminas indispensables para el buen funcionamiento de nuestro cuerpo, se encuentran las del grupo B, la más famosa de las cuales es la vitamina B8, también llamada (sidenote: Biotina llamada vitamina B7 o B8 según los países. Esta vitamina desempeña un papel clave en el metabolismo de los glúcidos, los lípidos y los aminoácidos. También interviene en la biosíntesis de otras vitaminas (B9 y B12). Numerosos alimentos son buenas fuentes de biotina (cereales integrales, huevos, leche, avellanas...). Esta vitamina también es sintetizada por las bacterias de la microbiota intestinal. Biotin_NIH National Cancer Institut ) . Una de las principales proveedoras de biotina es la alimentación, ¡pero no solo esta! Las bacterias de la microbiota intestinal también la fabrican… o no. Con consecuencias para la salud, sobre todo en caso de obesidad.
x11 La obesidad grave se multiplicó por 11 en los hombres
x3 y por 3 en las mujeres entre 1975 y 2014, en el mundo.
En efecto, un equipo de investigadores acaba de demostrar que, en los pacientes con una obesidad grave ( (sidenote: Indice de Masa Corporal (IMC) El Indice de Masa Corporal (IMC) evalúa la constitución de una persona al estimar la masa grasa corporal calculada por una relación entre el peso (kg) y la altura (m). https://www.nhlbi.nih.gov/health/educational/lose_wt/BMI/bmicalc.htm https://www.euro.who.int/en/health-topics/disease-prevention/nutrition/a-healthy-lifestyle/body-mass-index-bmi ) >35), las bacterias intestinales productoras y transportadoras de biotina están desaparecidas. Su huésped obeso, aunque sus necesidades son mayores (la vitamina B es necesaria para el equilibrio del tejido adiposo), se ve privado de esta fuente complementaria a la alimentación. Los experimentos con animales ponen en evidencia que la (sidenote: Dieta occidental Alimentación rica en alimentos transformados, azúcar refinado, sal, grasas saturadas (carne roja) y grasas trans (bollería). Zinöcker MK, Lindseth IA. The Western Diet-Microbiome-Host Interaction and Its Role in Metabolic Disease. Nutrients. 2018 Mar 17;10(3):365. ) , factor bien conocido por favorecer la obesidad, produce una disminución de las bacterias intestinales productoras de biotina, así como una reducción de los niveles circulantes de esta vitamina en el suero. Por otra parte, la inflamación intestinal, observada en los pacientes obesos, limita paradójicamente su absorción cuando esta procede de la alimentación.
En caso de obesidad grave, se establece pues un círculo vicioso, puesto que la disbiosis intestinal empeoraría la inflamación (y la obesidad) y la carencia tisular de biotina.
¿Cómo salir de este círculo vicioso? La cirugía de la obesidad (o bariátrica), que mejora el metabolismo y la inflamación, favorece a las bacterias productoras de biotina y produce un aumento —al menos durante el primer año— de la concentración de biotina circulante en el cuerpo. Otra pista: la suplementación con prebióticos (fibras de tipo fructooligosacáridos) y biotina. Las pruebas en ratones alimentados con una dieta rica en grasas muestran que mejora la diversidad de la microbiota intestinal, potencia la producción bacteriana de biotina y de otras vitaminas del grupo B, a la vez que limita el aumento de peso y el deterioro de la glucemia.

"Interesante" - Comentario traducido de Christine Lange (De My health, my microbiota)
 ¿Existe una relación entre la microbiota intestinal y la corpulencia?
¿Existe una relación entre la microbiota intestinal y la corpulencia?
La esclerosis múltiple (EM), una enfermedad neurodegenerativa autoinmune, afecta a 2,5 millones de personas en el mundo. Un estudio reciente publicado en eBioMedicine pone en evidencia una red de asociaciones entre el consumo de carne, el aumento de ciertos metabolitos sanguíneos, marcadores proinflamatorios, y una disminución de las bacterias que digieren los polisacáridos en los pacientes que presentan esta enfermedad. Explicaciones.
Aunque las últimas investigaciones mostraron una implicación de la microbiota intestinal (MI) en la patogenia de la EM, sus mecanismos todavía se conocen mal.
Por primera vez, un equipo de investigación se interesó por las interconexiones entre la dieta alimentaria, el sistema inmunitario, el metabolismo y la microbiota intestinal en el desarrollo y la progresión de la EM. Para ello, se utilizó una metodología multiómica.
Este enfoque inédito fue objeto de un estudio de 6 meses. Se obtuvieron muestras de sangre y heces de 49 participantes (24 pacientes con una EM no tratados y 25 individuos no enfermos) al inicio del estudio y 6 meses más tarde. Los perfiles metabólicos y la MI de todos los participantes se mantuvieron estables durante más de 6 meses. También se pidió a los participantes que registraran lo que habían ingerido en cada comida.
Como en estudios anteriores similares, la estructura de las comunidades bacterianas era globalmente parecida en los dos grupos. Sin embargo, los pacientes con una EM presentaban una menor cantidad de bacterias con propiedades inmunomoduladoras. Además, según el grado de invalidez de los pacientes, su microbiota difería, lo cual sugiere que ciertas especies podrían asociarse a la gravedad de la enfermedad.
Los resultados de los análisis multiómicos sugieren también disfunciones en la homeostasis de las relaciones entre microbioma y sistema inmunitario. En efecto, se observó una disociación de las interacciones entre las células inmunitarias y el microbioma, así como una modificación del perfil metabólico sanguíneo, en el grupo de pacientes que presentaban una EM.
El estudio del diario alimentario de los participantes desempeñó un papel clave en el proceso.
En efecto, se constató que el consumo de carne era superior en los pacientes con una EM. Este consumo se correlacionaba con un aumento de la cantidad de células Th17, implicadas en el proceso de autoinmunidad, y de S-adenosil-L-metionina (SAM), un metabolito producido a partir de la metionina (aminoácido abundante en la carne) e implicado en la activación de las células Th17. En cambio, los pacientes con una EM tenían una proporción reducida de B. thetaiotaomicron, una bacteria conocida por su gran capacidad de digerir los polisacáridos.
Estos datos ponen en evidencia la existencia de vías de interacción entre la alimentación, la microbiota intestinal, la respuesta inmunitaria y el metaboloma sanguíneo a través de B. thetaiotaomicron, Th17 y SAM. Para los autores, estos resultados sugieren que una restricción alimentaria de carne o de metionina podría disminuir el número de células inflamatorias circulantes Th17 en los pacientes con una EM.
Comprender mejor las vías de regulación entre alimentación, metabolitos, respuesta inmunitaria y microbiota para prevenir el empeoramiento de la esclerosis múltiple es el reto de este estudio con resultados prometedores, que podría abrir la vía a nuevas dianas terapéuticas. Este estudio, especialmente resaltado por la prensa médica, presenta un interés clínico particular que no dejará de abordarse con motivo del Día Mundial de la EM, el 30 de mayo próximo.
 El microbioma intestinal y las enfermedades inflamatorias crónicas
El microbioma intestinal y las enfermedades inflamatorias crónicas
 Microbioma intestinal y procesos neurodegenerativ
Microbioma intestinal y procesos neurodegenerativ
Únase al Dr. Eamonn Quigley, en este curso gratuito de formación médica continuada, mientras revisa los datos más recientes e interesantes sobre la "interacción entre la microbiota y los síntomas gastrointestinales".

¡Este curso fue totalmente actualizado en 2025!
44% Solo 2 personas de cada 5 declaran que han recibido información de su médico sobre los comportamientos adecuados para mantener una microbiota equilibrada
¿Afecta la microbiota a los síntomas gastrointestinales? La respuesta es sí, como se ha demostrado ampliamente en la literatura. Pero entonces, ¿podemos utilizar la microbiota para tratar los síntomas gastrointestinales? Únete al Dr. Eamonn Quigley en esta revisión de los datos más recientes e interesantes sobre la interacción entre la microbiota y los síntomas gastrointestinales. Revisaremos los efectos de la microbiota en los síntomas gastrointestinales superiores e inferiores (centrándonos en el síndrome del intestino irritable), el hábito intestinal, la hinchazón, la flatulencia y la distensión, y obtendremos algunos consejos prácticos para proporcionar la mejor atención a nuestros pacientes con síntomas gastrointestinales. ¿Te lo vas a perder?
Xpeer Medical Education es la primera aplicación de formación médica que genera créditos del mercado, con vídeos de microaprendizaje divertidos de solo 5 minutos.
Con un algoritmo potente para personalizar la experiencia de usuario y el contenido, inspirado en las plataformas de streaming de vídeo más populares, Xpeer ofrece toda una nueva experiencia para la formación continuada y el desarrollo de los profesionales sanitarios.
La aplicación, acreditada por la Unión Europea de Médicos Especialistas, ofrece formación médica científica de gran calidad. En Xpeer, encontrará este programa sobre la microbiota y 500 horas de educación médica en 2021 en su especialidad, además de cursos de formación tecnológica y desarrollo de capacidades profesionales y personales.
La aplicación Xpeer está acreditada por el Consejo Europeo de Acreditación para la Formación Médica Continua (EACCME) y concede créditos ECMEC reconocidos oficialmente en 26 países.
Los participantes del módulo obtienen 1 crédito FMF Europeo (ECMEC) por cada hora de formación (60 minutos efectivos de e-learning, excluyendo las introducciones…). Este crédito se adquiere una vez completado el módulo y validada la evaluación correspondiente por los participantes.

"Buen trabajo" -@SnHQuang2 (De Biocodex Microbiota Institute en X)
"Me gusta" -@CnBalinh (De Biocodex Microbiota Institute en X)
