Microbiote intestinal, système nerveux central et neurodéveloppement
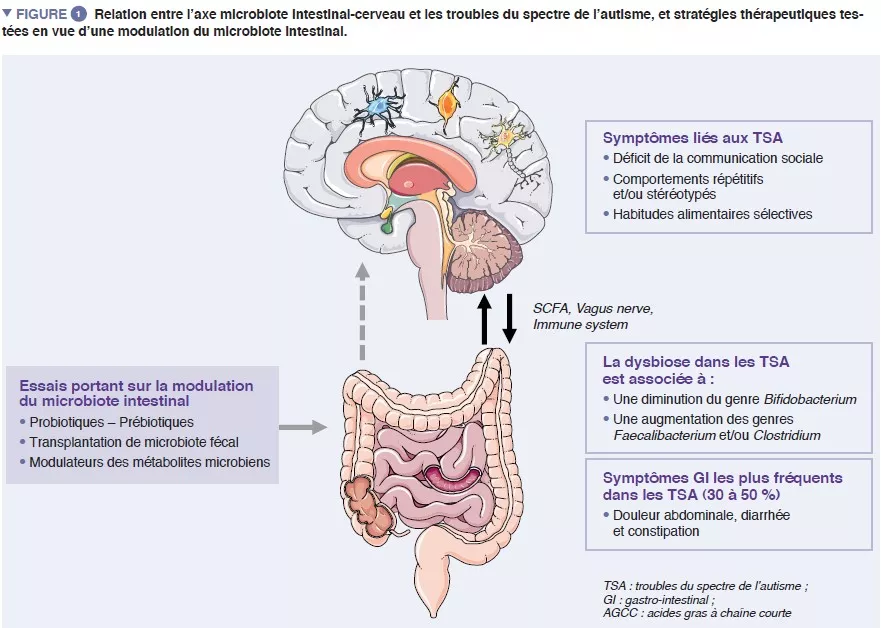
Le microbiote intestinal (MI) humain est composé d’environ 1013 micro-organismes, pour la plupart des bactéries, des champignons et des virus. Le MI joue un rôle central dans la santé humaine en assurant de nombreuses fonctions : barrière intestinale, modulation de la réponse immunitaire et de la synthèse métabolique, ou encore protection directe contre les infections. La dysbiose, caractérisée par un déséquilibre du MI, a été associée à différentes maladies telles que les maladies inflammatoires chroniques de l’intestin (MICI), les cancers, le diabète ou l’obésité [4]. Des éléments concordants suggèrent également l’existence d’interactions importantes entre le MI et le système nerveux central (SNC) [5] (Figure 1).
Des interactions réciproques entre le cerveau et le MI sont assurées par des métabolites microbiens (principalement des acides gras à chaîne courte) et des modulateurs immunitaires, directement par le franchissement des barrières hémato-intestinale et hémato-encéphalique et indirectement par la stimulation du nerf vague [6]. Des preuves appuient l’implication du MI dans la régulation des comportements et des fonctions cognitives chez l’être humain – en particulier les capacités socio-communicationnelles – même si les mécanismes exacts demeurent inconnus [5].
Les TSA sont des troubles du neurodéveloppement caractérisés par des difficultés de communication et d’interactions sociales et des comportements répétitifs/ stéréotypés, apparaissant dans l’enfance et touchant environ 1 % de la population générale. Les TSA sont en grande partie d’origine génétique, avec une héritabilité estimée atteignant 0,8-0,9, mais des événements environnementaux pré- et postnataux pourraient constituer des facteurs déclenchants ou des modulateurs de la sévérité des symptômes. La trajectoire du développement du cerveau aux premiers stades de la vie se chevauche avec celle du MI. En effet, ce dernier commence à se développer peu après la naissance et sa composition se stabilise pour adopter un profil proche de celui de l’adulte vers l’âge de 3 ans. Dans les premiers temps, la composition du MI est fortement influencée par des facteurs environnementaux tels que le lieu de naissance, le mode d’accouchement, l’allaitement et les xénobiotiques (utilisation d’antibiotiques p. ex.).
Les souris « axéniques » constituent un modèle totalement dépourvu de micro-organismes, microbiologiquement stérile (aucun organisme vivant ne peut être mis en culture). Les modèles murins axéniques sont très utiles pour déchiffrer les mécanismes expliquant les rôles joués par le MI dans le neurodéveloppement, mais également les relations existant entre le microbiote et la maladie. Des études ont montré que les souris axéniques présentaient (i) un défaut de la perméabilité de la barrière hémato-encéphalique ; (ii) un volume cérébral plus important ; (iii) une expression génique indiquant une microglie plus immature et une moindre réponse immunitaire microgliale ; (iv) une augmentation de la myélinisation ; et (v) une diminution de l’expression du facteur neurotrophique dérivé du cerveau et d’une sous-unité des récepteurs N-méthyl-D-aspartate [5, 7]. Toutes ces données soulignent le rôle du MI dans la formation et l’intégrité de la barrière hémato- encéphalique, la neurogenèse, l’homéostasie microgliale, la myélinisation et la croissance/fonction cérébrale.
Microbiote intestinal, symptômes gastro-intestinaux et Troubles du Spectre de l'Autisme
Les souris axéniques ont présenté des comportements de type autistique tels que l’évitement social, des comportements répétitifs/ stéréotypés et un manque d’intérêt pour la nouveauté sociale. Certains de ces comportements ont disparu après colonisation par un MI provenant de souris de type sauvage, alors que la colonisation par un MI provenant de modèles murins de TSA a accentué ces comportements. Le MI semble en effet crucial pour la programmation et la présentation des capacités sociales et des comportements adaptatifs [8].
Un nombre croissant de preuves montrent que les symptômes GI sont sur-représentés chez les enfants atteints de TSA. Des symptômes GI tels que douleur abdominale, constipation et diarrhée sont rapportés chez près de 30 à 50 % des patients atteints de TSA et ils impactent fortement la qualité de vie des enfants [1]. La sévérité des symptômes GI a été corrélée à celle des symptômes autistiques et la dysbiose intestinale est bien documentée, même s’il n’existe pas encore de signature spécifique liée aux symptômes autistiques. Des études analysant le MI ont rapporté des différences au niveau de la diversité microbienne ainsi que des anomalies dans les profils des métabolites par rapport aux témoins sains. Deux récentes méta-analyses étudiant la composition du MI chez des patients atteints de TSA ont rapporté une diminution du genre Bifidobacterium et une augmentation des genres Faecalibacterium et Clostridium chez les patients atteints de TSA [9, 10] par rapport aux témoins. L’analyse du métabolome fécal a également montré une augmentation du p-crésol, un métabolite bactérien dérivé de la tyrosine, chez les personnes atteintes de TSA. Toutes ces données pourraient indiquer une association potentielle entre les anomalies du MI et les symptômes GI chez les patients atteints de TSA.
Cependant, la plupart des études présentent des résultats hétérogènes et des limites méthodologiques. Il existe en effet des facteurs de confusion qui constituent un inconvénient majeur, notamment le fait que ces études soient conduites dans des pays différents, avec des habitudes alimentaires et des modes de vie différents. D’ailleurs, une étude récente portant sur une vaste cohorte de 247 patients atteints de TSA n’a pas mis en évidence de lien direct entre le diagnostic de TSA ou les symptômes autistiques et la dysbiose du MI. La dysbiose a été associée à une alimentation moins diversifiée, qui est fréquente chez les patients atteints de TSA [8].
La modulation du microbiote intestinal dans les Troubles du Spectre de l'Autisme
Un nombre croissant d’études ont analysé l’impact potentiel des stratégies thérapeutiques basées sur le microbiote sur l’amélioration des symptômes GI et des symptômes typiques de l’autisme chez les personnes atteintes de TSA.
Les probiotiques, des micro-organismes vivants, ont été utilisés dans les TSA et pourraient avoir un effet bénéfique chez les patients concernés. Des études précliniques ont montré une augmentation des interactions sociales avec une supplémentation en probiotiques (Bacteroides fragilis NCTC9343, Lactobacillus reuteri MM4-1A) dans des modèles murins de TSA. L’amélioration de la communication sociale était liée à une augmentation de l’expression d’ocytocine dans le SNC. Chez l’être humain, plusieurs études ont fait état d’effets positifs des traitements probiotiques sur la composition du MI et les symptômes GI dans les TSA [11]. Cependant, peu ont rapporté une amélioration des symptômes typiques de l’autisme. Dans la plupart des essais cliniques utilisant des probiotiques chez des autistes, on a observé des disparités en termes de probiotiques utilisés, de dose administrée par jour ou au total, et de durée du traitement. Même si certaines études suggèrent que les probiotiques pourraient être intéressants pour prévenir les symptômes GI chez les patients atteints de TSA, les résultats doivent être répliqués afin de garantir l’effet positif de cette stratégie.
De la même manière, l’efficacité des prébiotiques, comme le galacto-oligosaccharide (GOS) ou le fructo-oligosaccharide, a été étudiée dans les TSA [12]. Des souris soumises à un stress chronique ont montré une altération du MI et une diminution de l’intérêt social. Avec ce modèle murin, l’administration des prébiotiques a été associée à une augmentation des interactions sociales chez ces souris. Chez l’être humain, l’utilisation de GOS associé à une alimentation sans caséine et sans gluten a montré une amélioration des symptômes GI et des interactions sociales ainsi qu’une augmentation de l’abondance de Bifidobacterium dans le MI. Des études cliniques randomisées en double aveugle appropriées sont nécessaires pour confirmer les données préliminaires.
La transplantation de microbiote fécal (TMF) a également été étudiée dans les TSA. La TMF consiste à transplanter le MI d’un donneur afin de modifier le MI du receveur. Son efficacité dans l’infection à Clostridioides difficile est désormais bien démontrée, même chez l’enfant. Récemment, un essai clinique exploratoire en ouvert et non randomisé portant sur 18 enfants atteints de TSA et présentant des symptômes GI a évalué l’effet de la thérapie de transfert de microbiote (TTM) - un protocole de TMF modifié [13]. La TTM comprenait un traitement antibiotique de 2 semaines, une préparation colique puis le transfert de microbiote consistant en l’administration d’une forte dose par voie orale ou rectale suivie d’une dose d’entretien par voie orale pendant 7 à 8 semaines. Des événements indésirables (comportements perturbateurs, hyperkinésie) ont été observés au début du traitement par vancomycine, mais ont disparu spontanément après 3 jours de traitement. Le protocole TTM a entraîné une amélioration significative des symptômes GI après le suivi de 8 semaines. Plus surprenant, une amélioration des symptômes typiques de l’autisme (comportements stéréotypés et répétitifs, altération des capacités de communication sociale) a également été observée 8 semaines après la TTM. Il est intéressant de noter que l’amélioration des symptômes GI et autistiques a persisté 2 ans après le traitement et qu’elle était corrélée à une augmentation de la diversité du MI [14]. Deux ans après la TTM, la réduction moyenne du score total à l’échelle GSRS (Gastrointestinal Symptom Rating Scale) était toujours de plus de 50 %. Les variations des symptômes autistiques mesurées à l’aide des échelles CARS (Childhood Autism Rating Scale), SRS (Social Responsiveness Scale) ou ABC (Autistic Behavior Checklist) étaient toutes positivement corrélées aux pourcentages de variation des scores GSRS. Ces résultats ne sont pas encore confirmés par des études randomisées en double aveugle et contrôlées versus placebo.
Récemment, un essai clinique pilote en ouvert conduit dans les TSA a évalué l’effet d’un adsorbant GI administré par voie orale (AB-2004) qui module différents métabolites du MI. Les auteurs ont fait état d’une diminution des comportements de type anxieux chez la souris, induite par une diminution de métabolites microbiens intestinaux [15]. Ils ont également présenté les résultats préliminaires d’un essai clinique au cours duquel une dose d’AB- 2004 ajustée en fonction du poids a été administrée pendant 8 semaines à 30 adolescents atteints de TSA. À la semaine 8, des taux réduits de métabolites du MI ont été observés dans le plasma et l’urine. Plus intéressant encore, après le traitement, un nombre moins important de patients présentaient des symptômes GI mais également des comportements associés aux TSA, à savoir l’anxiété et l’irritabilité. Un effet rémanent a également été observé, avec une persistance de l’efficacité 4 semaines après l’arrêt du traitement [15]. Les facteurs reliant les améliorations cliniques et l’administration d’AB-2004 doivent encore être déterminés, et des facteurs indirects n’ont pas été étudiés, notamment l’effet de l’AB-2004 sur les modifications nutritionnelles, le statut immunitaire ou la fonction GI. Des études en double aveugle contrôlées versus placebo à plus grande échelle sont nécessaires pour mieux comprendre le rôle de l’AB-2004 dans la communication sociale chez l’être humain.
Face à l’absence de traitement spécifique pour les symptômes GI et autistiques chez les patients atteints de TSA, de nouvelles stratégies thérapeutiques bien tolérées ciblant le MI ou les métabolites microbiens, telles que la TMF/TTM, doivent être davantage évaluées, en particulier aux stades précoces et critiques du développement cérébral pendant l’enfance.