Les inhibiteurs de points de contrôle immunitaire (ICI) ont révolutionné la prise en charge de certains cancers, offrant à des patients une survie globale supérieure à celle espérée avec une chimiothérapie, notamment dans le cancer du poumon non à petites cellules (CPNPC) ou le mélanome. Mais chez d’autres patients, la réponse à ce traitement n’est pas celle espérée. Une différence qui pourrait en partie être liée au microbiote intestinal qui affecterait l’efficacité des ICI.
Ni trop, ni trop peu d’Akk dans le cancer du poumon
Une première étude multicentrique rétrospective a analysé le microbiote de 338 patients français atteints de CPNPC avancé afin de prédire le bénéfice des anti-PD-1, un des traitements par ICI. Objectif : conforter des résultats antérieurs obtenus sur de plus petites cohortes qui laissaient supposer que la composition du microbiote intestinal, et plus particulièrement la présence de la bactérie Akkermansia muciniphila (Akk), pourrait être un biomarqueur prédictif des réponses et taux de survie à 12 mois.
Les résultats ? L'abondance relative d'Akk était bien associée au bénéfice clinique (meilleur taux de réponse, meilleure survie). De plus, la présence intestinale d'Akk était un indicateur de la richesse de l'écosystème intestinal. Elle allait de pair avec une communauté bactérienne spécifique, associée à la santé ou au statut immunogène, représentée notamment par des Ruminococcacae et Lachnospiraceae, ainsi que B. adolescentis et I. butyricyproducens.
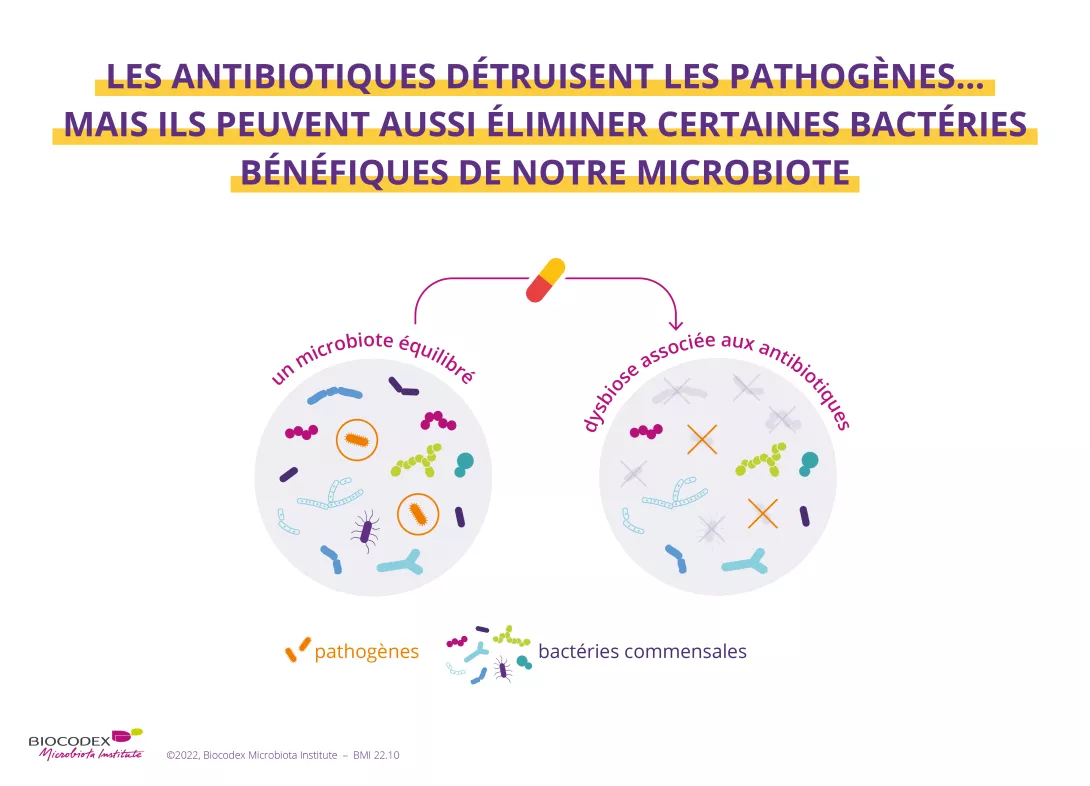
Néanmoins, une bonne survie passerait par une juste abondance d’Akk : ni trop peu, ni trop. En effet, la prise d’antibiotiques (20 % des cas) favorisait une sur-abondance d'Akk et du genre Clostridium, tous deux associés à une résistance aux ICI et à un pronostic défavorable (durée de survie réduite). Il semble donc que la dysbiose induite par les antibiotiques réduise les bactéries favorables associées à la survie (telles que Ruminococcus), au profit de bactéries délétères associées à des voies pro-inflammatoires ou immunorégulatrices (telles que Escherichia coli et Clostridium bolteae). Et c’est donc l'abondance relative d'Akk qui pourraient représenter un biomarqueur potentiel (favorable ou défavorable), pour affiner la stratification des patients souffrant de CPNPC et recevant une immunothérapie anti PD-1. Voire pour améliorer leur réponse au traitement via une supplémentation en Akk.
Des relations plus complexes qu’anticipées
Une seconde étude reposant cette fois sur 5 cohortes déjà publiées (n = 147) et 5 nouvelles cohortes (n = 165) confirme que le microbiome intestinal est associé à la réponse aux ICIs ou à la survie en cas de mélanome avancé… mais cette association s’avérait dépendante de la cohorte étudiée. Autrement dit, chaque cohorte avait sa propre signature. Conséquence directe : aucune espèce unique ne peut être considérée comme un biomarqueur commun aux différentes études. Au contraire, un panel d'espèces, comprenant Bifidobacterium pseudocatenulatum, Roseburia spp. et Akk., pourrait constituer un tel biomarqueur.
Ainsi, cette seconde étude confirme ce que laissait transparaître la première : le rôle du microbiote intestinal humain dans la réponse à l'ICI serait plus complexe qu'on ne le pensait. La présence ou l’absence d’une espèce bactérienne, voire son abondance, et notamment celle d’Akk, ne suffit pas à définir les patients répondeurs ou non-répondeurs au traitement par ICIs.