Microbiota intestinal: ainda existem muitas coisas a descobrir
Microbiota. Acabou de descobrir esta palavra. Bem, primeira boa notícia: está no artigo certo para saber mais sobre ela. O que está por detrás desta palavra? Quais são os principais avanços? O que é que ainda temos de descobrir? A Dra. Deanna Gibson conta-lhe tudo sobre o assunto.
BMI 22.34

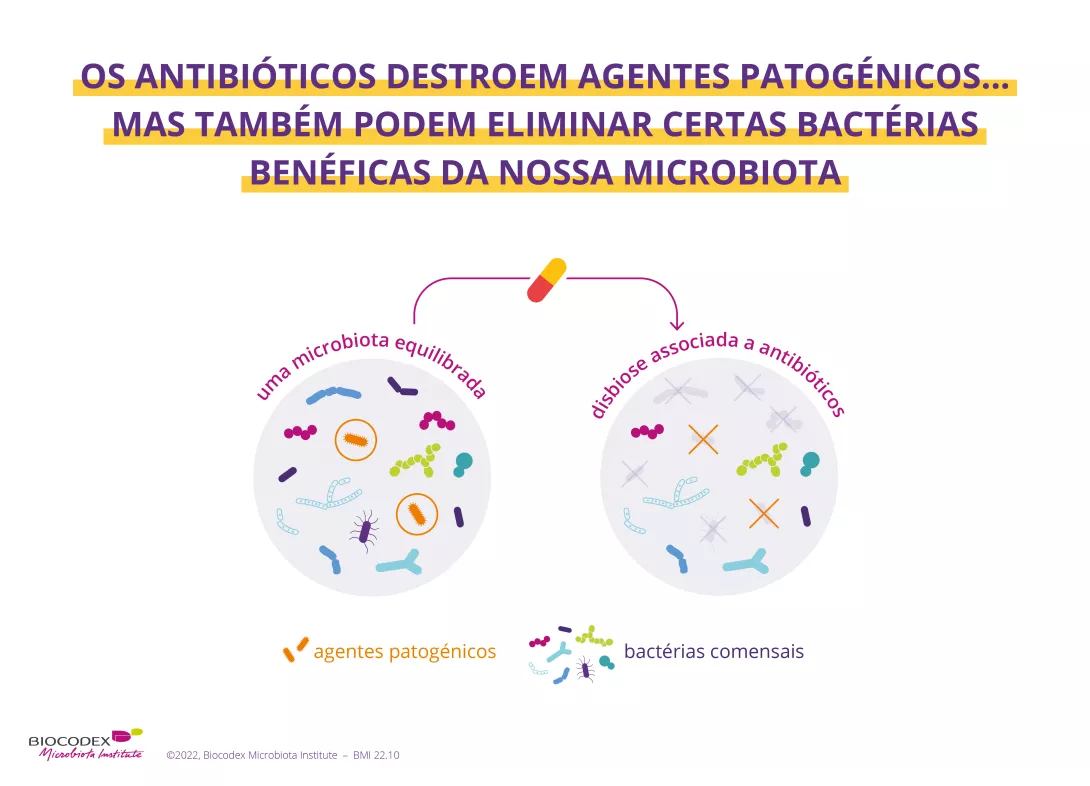
Existe muita investigação no campo da microbiota intestinal.
No seu ponto de vista, qual é o maior desenvolvimento nestes últimos anos?
Deanna Gibson: Há pouco mais de uma década, os cientistas começaram a apreciar a divulgação e amplitude dos efeitos que a microbiota tem na saúde humana. Ainda assim, embora muito entusiasmo tenha surgido ao longo dos anos ao considerar o microbioma como um fator importante associado a muitas doenças, uma dose saudável de ceticismo também estava presente para tentar explicar a falta de uma peça importante do puzzle de forma a explicar doenças importantes como a :
As descobertas, de há uma década atrás, vieram da utilização de (sidenote: Ratos axénicos Ratos sem germes, criados em ambiente estéril ) frequentemente transplantados com fezes humanas de várias doenças, o que orientou a nossa visão de que o microbioma era central em muitos processos fisiológicos dos mamíferos. As primeiras evidências demonstraram que o intestino humano era um ambiente perfeito para muitos micróbios, o que ajudou a impulsionar a relação benéfica entre nós e os nossos micróbios. Os próprios (sidenote: Microrganismos Organismos vivos que são demasiado pequenos para serem vistos a olho nu. Incluem as bactérias, os vírus, os fungos, as arqueias, os protozoários, etc., e são vulgarmente designados "micróbios". What is microbiology? Microbiology Society. ) são vitais para respostas imunitárias equilibradas e eficazes, uma vez que os seus pedaços atuam como uma chave nas nossas entranhas, que desbloqueia respostas que nos mantêm protegidos e saudáveis.

“Os microrganismos são vitais para respostas imunitárias equilibradas e eficazes”
Os estudos sobre a obesidade que revelam relações entre o microbioma intestinal e o metabolismo energético, utilizando transplantes fecais de humanos em ratos sem germes,2 transformaram a forma como compreendemos o papel dos microrganismos intestinais na origem e regulação da obesidade. Estas observações cativaram-nos desde que algumas experiências sagazes descobriram que a (sidenote: Regime ocidental Alimentação rica em alimentos transformados, em açúcar refinado, sal, gorduras saturadas (carnes vermelhas) e gorduras trans (produtos panificados) Zinöcker MK, Lindseth IA. The Western Diet-Microbiome-Host Interaction and Its Role in Metabolic Disease. Nutrients. 2018 Mar 17;10(3):365. ) resultou na extinção de micróbios, o que foi agravado ao longo de várias gerações.3
A microbiota intestinal
Efetivamente, o intestino ocidental, faminto por fibra, tinha sido substituído por micróbios que mastigam o nosso (sidenote: Muco Sustancia protectora que se excreta en numerosas zonas del cuerpo (boca, garganta, pulmones, intestinos, estómago...). El moco está formado por varios componentes, pero el principal es una sustancia llamada mucina. Las mucinas en el moco pueden actuar como una barrera selectiva, lubricante, o como una materia viscosa, dependiendo de su estructura. Estudios recientes han mostrado que la maduración y la función de la capa de moco se ven muy influenciadas por la microbiota intestinal. Brandtzaeg P. (2017) Role of the Intestinal Immune System in Health. In: Baumgart D. (eds) Crohn's Disease and Ulcerative Colitis. Springer, Cham. Schroeder BO. Fight them or feed them: how the intestinal mucus layer manages the gut microbiota. Gastroenterol Rep (Oxf). 2019 Feb;7(1):3-12. ) protetor do intestino, potenciando a erosão do cólon e um intestino insalubre.4 Estes estudos convincentes moldaram a forma como víamos o microbioma e as evidências inegáveis de que o microbioma era de facto um fator chave em muitas doenças crónicas.
Os estudos sobre a obesidade que revelam relações entre o microbioma intestinal e o metabolismo energético, utilizando transplantes fecais de humanos em ratos sem germes:
![[Infographic] Relationship between the gut microbiota and energy metabolism (PT)](/sites/default/files/styles/wide/public/2022-06/%5BInfographic%5D%20Relationship%20between%20the%20gut%20microbiota%20and%20energy%20metabolism%20%28PT%29.png.webp?itok=OXST6OGE)
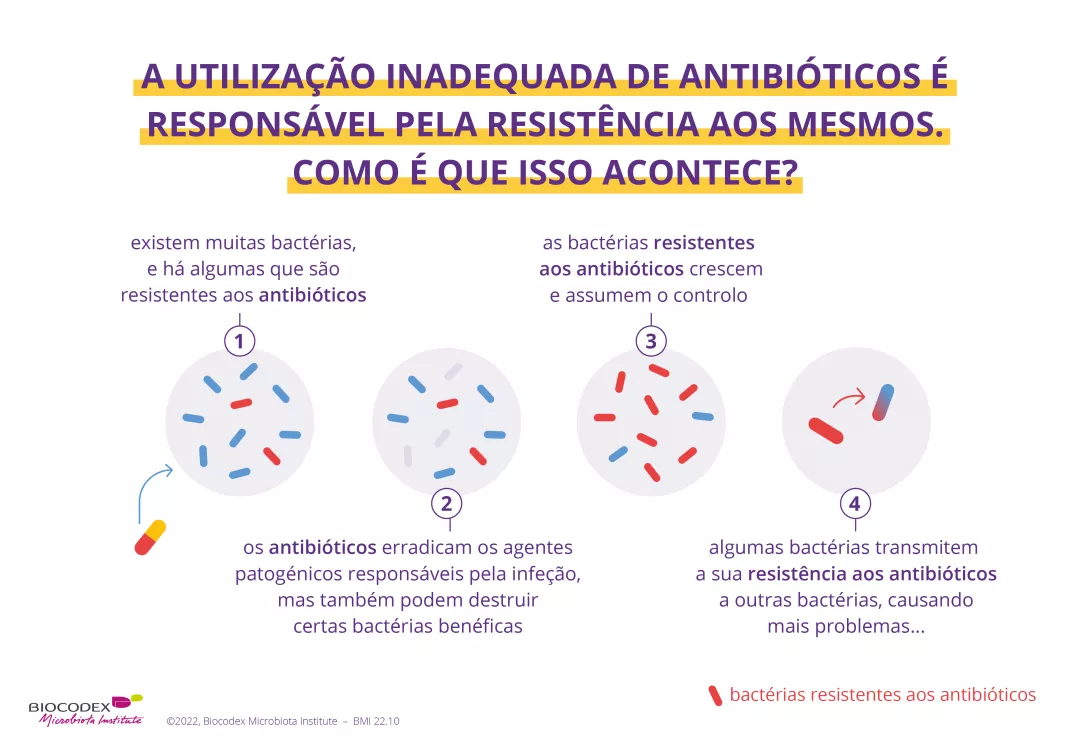
O avanço do eixo do cérebro intestinal
Mais recentemente, a área foi novamente revolucionada com as nossas novas perceções de que a microbiota intestinal forma um eixo com o cérebro.
Muitos cientistas supõem que uma ponte entre o intestino e o cérebro promove a morfologia cerebral, a neurogénese e comportamentos complexos. Existem evidências consideráveis de que moléculas ou (sidenote: Metabolitos Pequenas moléculas produzidas durante o metabolismo celular ou bacteriano. Os ácidos gordos de cadeia curta são, por exemplo, metabólitos produzidos pela microbiota intestinal durante a fermentação de açúcares complexos não digestivos (fibras...). Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. Lamichhane S, Sen P, Dickens AM, et al An overview of metabolomics data analysis: current tools and future perspectives. Comprehensive analytical chemistry. 2018 ; 82: 387-413 ) influenciados pelos microrganismos, talvez até produzidos por micróbios, podem sinalizar através do sistema nervoso central e influenciar comportamentos incluindo psicose, ansiedade, até mesmo personalidade, e certamente condições neuroinflamatórias.5
Os cientistas devem ainda afirmar um papel causal da microbiota nos processos cerebrais. Um estudo recente revelou o papel da microbiota intestinal nos comportamentos sociais através de circuitos neuronais que medeiam as respostas ao stress no cérebro. Parece que bactérias específicas na nossa flora intestinal podem limitar a ativação de eixos neuronais cerebrais específicos.6 Este avanço nas áreas de ligação entre a microbiota intestinal e a neurologia dá-nos esperança de que ao mudarmos os microrganismos que temos nos nossos corpos, podemos ter melhor controlo sobre os nossos estados de espírito, escolhas e função cognitiva.
A microbiota intestinal humana é considerada o nosso segundo cérebro.
O que podemos hoje afirmar com certeza relativamente à implicação da microbiota intestinal na saúde humana ou nas doenças?
D.G.: Muitas pessoas reconheceram de facto que a microbiota intestinal é considerada o nosso segundo cérebro. As evidências indicam que a microbiota está implícita no controlo de processos fisiológicos que influenciam a saúde humana e a doenças. Embora seja necessário um grau de ceticismo saudável ao avaliar os dados microbiológicos, seria difícil refutar evidências chave e específicas, incluindo o papel da microbiota intestinal no metabolismo energético com consequências na saúde metabólica. Além disso, é evidente que a microbiota intestinal também influencia a saúde cardiovascular uma vez que os estudos que utilizam ratos sem micróbios têm menos desenvolvimento vascular.

“Os tipos de micróbios presentes no intestino podem prever o sucesso da terapia contra o cancro”
Outros efeitos fisiológicos críticos da microbiota intestinal incluem o desenvolvimento de células imunitárias, (sidenote: Tolerância imune Estado de não resposta do sistema imunitário a substâncias ou tecidos que têm o potencial de induzir uma resposta imunitária. Immune tolerance_Nature portfolio ) , desenvolvimento cerebral, função hepática, e mesmo suscetibilidade a doenças infecciosas. Finalmente, a evidência de que a microbiota intestinal promove as terapias do cancro é convincente. Os dados mostram que os tipos de micróbios presentes no intestino podem prever o sucesso da terapia contra o cancro, revelando que os próprios micróbios são agentes ativos no metabolismo do medicamento hospedeiro.
As terapias inovadoras que se concentram na alteração do microbioma, incluindo as que se destinam à doença inflamatória intestinal, obesidade, diabetes, autismo, e transplantes fecais para o tratamento de infeções por Clostridioides difficile, podem ter mais sucesso do que as terapias atuais, incluindo o tratamento com antibióticos. Estes últimos revelam, pelo menos, algo nas fezes das pessoas saudáveis, seja um micróbio, um grupo de micróbios ou metabolitos, pode curar a infeção por C. difficile. O estudo de microrganismos únicos e ou vários combinados como medicamentos para doenças específicas será vital para confirmar o lugar da microbiota na medicina moderna.
A única indicação validada para TMF é a infecção recorrente associada ao Clostridioides difficile. Esta prática pode apresentar riscos para a saúde e deve ser realizada sob supervisão médica, não se reproduzir em casa!
O que temos ainda de descobrir?
Podemos imaginar em 10 anos visar a microbiota intestinal para diagnosticar ou tratar doenças associadas?
D.G.: Embora tenhamos aprendido na última década que devemos prestar atenção à grande infinidade de micróbios que vivem dentro (e fora) do nosso corpo, apenas andamos à superfície da área microbiológica. Na próxima década, pretendemos atribuir papéis mecanicistas específicos a tipos específicos de micróbios no microbioma, o que ajudará ainda mais a identificar probióticos novos e eficazes.

“Apenas andamos à superfície da área microbiológica”
Probióticos: o que são exatamente?
Agora que podemos ver como uma microbiota desequilibrada ( (sidenote: Disbiose A "disbiose" não é um fenómeno homogéneo – varia em função do estado de saúde de cada indivíduo. É geralmente definida como uma alteração da composição e do funcionamento da microbiota, causada por um conjunto de fatores ambientais e relacionados com o indivíduo que perturbam o ecossistema microbiano. Levy M, Kolodziejczyk AA, Thaiss CA, et al. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17(4):219-232. ) ) está associada a várias doenças, temos de aprender a redefinir este microbioma disfuncional com a esperança de que isto também redefina os processos inflamatórios e metabólicos que o microbioma influencia.
Dado que evidências recentes apoiam que o metabolismo dos medicamentos é alterado pela microbiota, o futuro da medicina terá de ser personalizado . Cada pessoa tem o seu próprio conjunto de micróbios que compõem o seu microbioma, o que significa que uma abordagem mais personalizada para resolver problemas médicos será inevitável.

“O futuro da medicina terá de ser personalizado”
Isto incluirá certamente terapêutica baseada em microbiologia ou mesmo orientações dietéticas personalizadas como terapias adjuvantes juntamente com medicamentos, uma vez que a alimentação é um dos indicadores mais significativos do microbioma intestinal.
O papel da microbiota intestinal na saúde humana :
Adaptado de Leah D. D'Aloisio
![[infographic] The role of the gut microbiota in human health (PT)](/sites/default/files/styles/wide/public/2022-06/%5Binfographic%5D%20The%20role%20of%20the%20gut%20microbiota%20in%20human%20health%20%28PT%29.png.webp?itok=kJ_Dt2gV)
Vários fatores, como estilo de vida, idade, padrões alimentares, utilização de antibióticos, genética e exercício podem influenciar a microbiota intestinal. Na última década, a investigação demonstrou que ocorre a comunicação bidirecional entre o eixo intestinal-cérebro, o que pode ter impacto no funcionamento do cérebro e influenciar doenças mentais, como ansiedade, depressão e esquizofrenia. Embora essencial para o desenvolvimento do nosso sistema imunitário, a microbiota intestinal também está envolvida em várias doenças, incluindo a doença inflamatória intestinal, doença vascular, obesidade, diabetes, doença hepática e alergias.
Quanto mais compreendermos sobre a microbiota intestinal, melhores serão as terapias que podemos disponibilizar. Os tratamentos futuros, como probióticos e transplante de microbiota fecal, ajudarão um microbioma doente a melhorar a saúde intestinal em geral.

Outras informações surpreendentes sobre a sua saúde com os nossos testes!
No Dia Mundial do Microbioma (World Microbiome Day), o Biocodex Microbiota Institute está a desvendar os segredos dos fascinantes microrganismos que habitam os nossos corpos. Saiba mais sobre o papel essencial da microbiota na sua saúde!
Recomendado pela nossa comunidade

"Esta página é realmente espetacular, para começar. Obrigado por falarem sobre este fator extremamente importante da nossa existência! A microbiota é algo de transversal a todas as raças de pessoas - todos devem ter o direito de ter uma microbiota saudável!" - Comentário traduzido de Chloe McAllinway (Da My health, my microbiota)
 Flora, microbiota, microbioma: falsos cognatos e sinónimos verdadeiros
Flora, microbiota, microbioma: falsos cognatos e sinónimos verdadeiros
 Burla, (falsa) ciência e publicações
Burla, (falsa) ciência e publicações