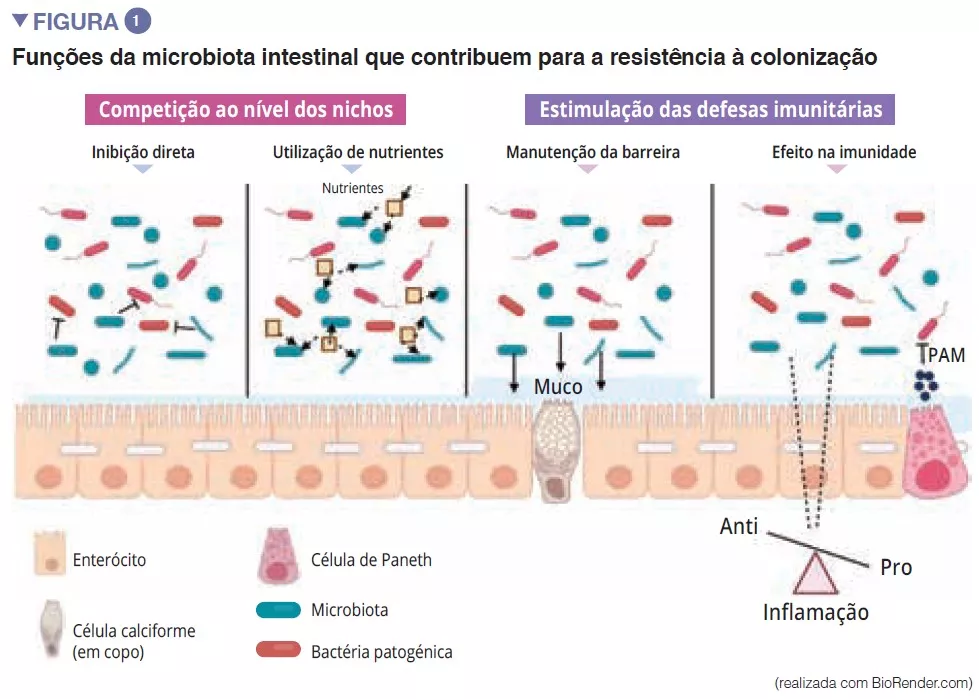
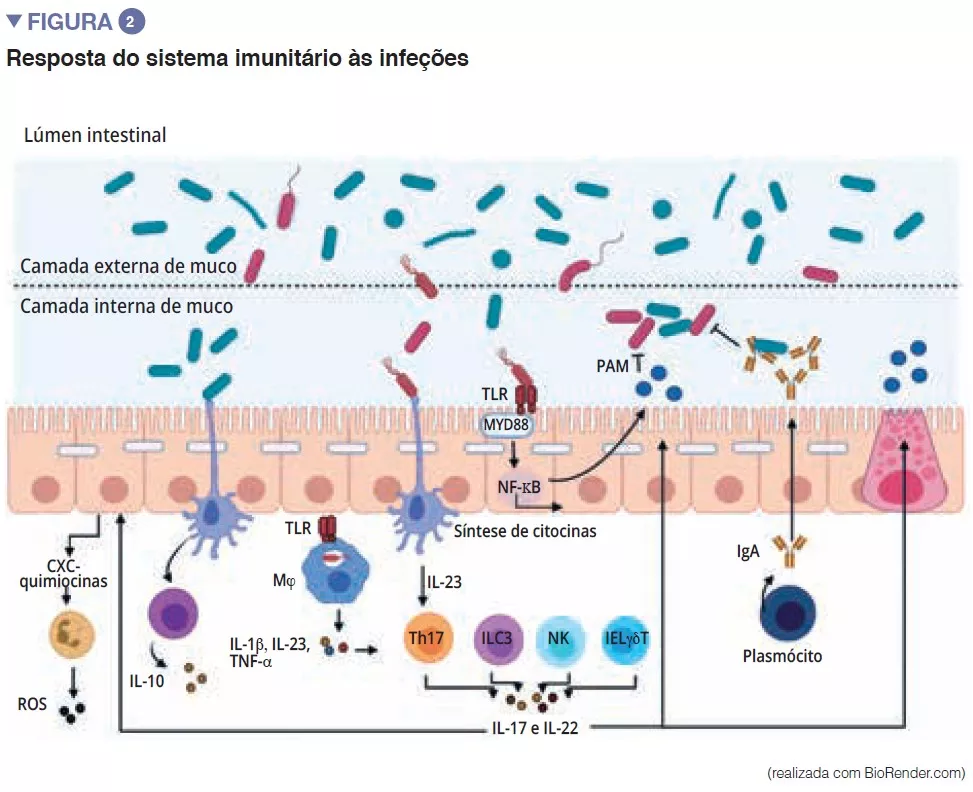
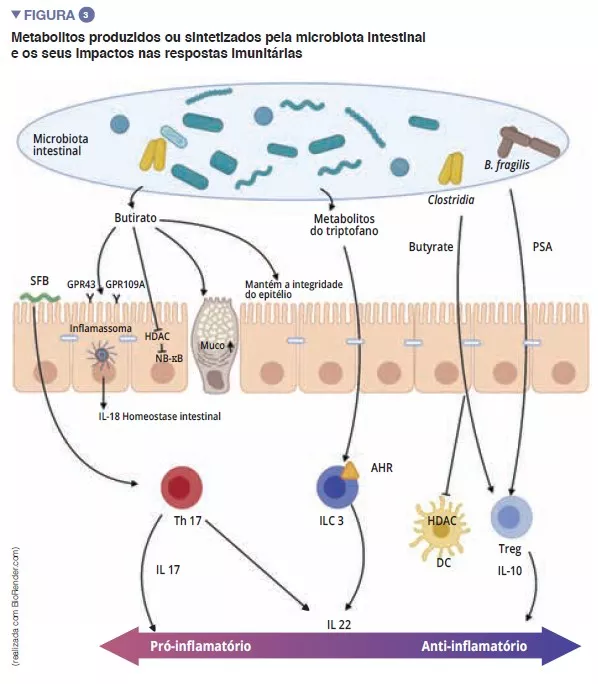
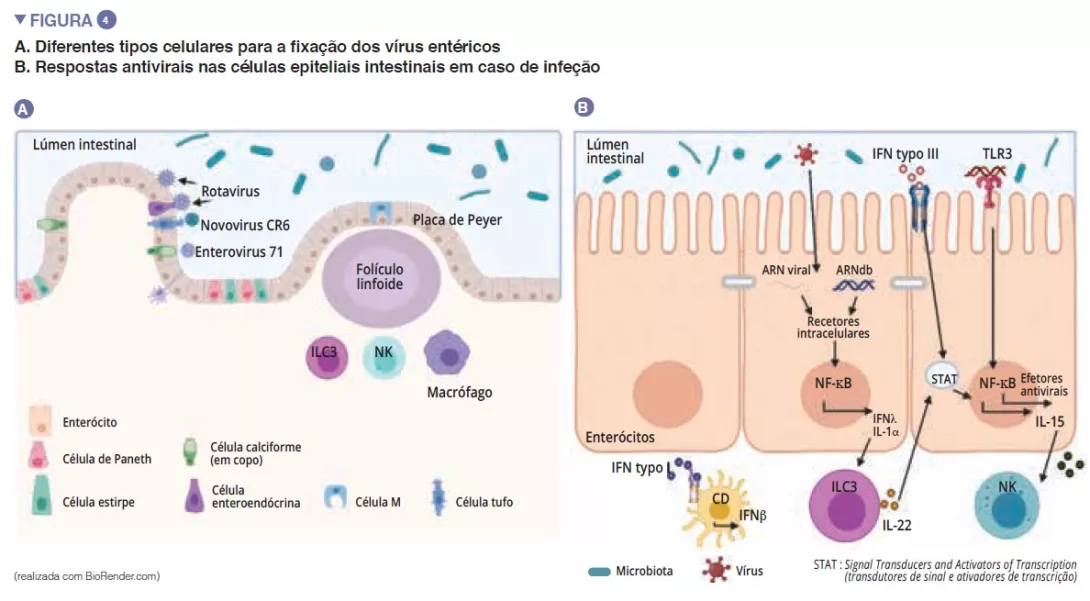
Destaques da microbiota da semana virtual ueg 2020
Feedback de congressos
Pelo Prof. Magnus Simrén
Departamento de Medicina Molecular e Clínica, Instituto de Medicina Academia Sahlgrenska, Universidade de Gotemburgo Gotemburgo, Suécia

Devido à pandemia em curso, a Semana UEG 2020 foi, pela primeira vez realizada de forma virtual. Tal como nos anos anteriores, o evento atraiu um grande número de resumos de alta qualidade, e destes, um número substancial focou-se no papel dos micróbios na saúde e na doença.
MICROBIOTA, FATORES AMBIENTAIS E FATORES DO HOSPEDEIRO NA SAÚDE E NA DOENÇA
O microbioma intestinal tem sido associado a um grande número de doenças, mas ainda não é claro como deve ser definido um microbioma saudável ou pouco saudável. Um grande estudo que foi desenvolvido em holandeses (OP178 R Gacesa et al.) demonstrou padrões microbianos comuns a várias doenças, incluindo doença inflamatória intestinal (DII), síndrome do intestino irritável (SII), asma, diabetes e perturbações mentais), tornando possível definir grupos de micróbios e funções intestinais ligados à saúde e à doença. Especificamente, verificou-se que o microbioma associado às doenças era caracterizado por um aumento significativo da prevalência e abundância de agentes patogénicos oportunistas dos géneros Clostridium, Gordonibacter e Eggerthella, devido a uma redução do catabolismo dos hidratos de carbono, da síntese de aminoácidos e vitaminas, e do aumento da síntese de ácidos gordos de cadeia longa. Por outro lado, o microbioma saudável mostrou uma grande abundância de comensais produtores de butirato dos géneros Alistipes, Roseburia, Faecalibacterium e Butyrivibrio. Os autores também mostraram que o microbioma foi principalmente moldado pelo ambiente e estilo de vida e, por conseguinte, concluíram que as alterações através da melhoria da dieta, dos estilo de vida e do ambiente, bem como o uso de probióticos podem ser defendidos para melhorar a saúde em geral. Além disso, um estudo de acompanhamento longitudinal (OP201 L Chen et al.) destacou que as alterações microbianas ao longo do tempo parecem ser impulsionadas por exposições ambientais e podem afetar a saúde metabólica do hospedeiro.
A MICROBIOTA NAS DOENÇAS INTESTINAIS
A restrição da lactose é a base do tratamento para evitar queixas gastrointestinais (GI) nos indivíduos que têm má absorção de lactose devido a deficiência de lactase. No entanto, a gravidade dos sintomas intestinais, como flatulência, inchaço e diarreia, após a ingestão de lactose varia substancialmente, e a razão para tal permanece pouco clara. Através de análises do projeto holandês Microbioma (OP177 MDF Brandao Gois et al.), foi demonstrado que existe um papel mediador e plausível do microbioma intestinal, na relação da ingestão de lacticínios e da ocorrência de sintomas intestinais em indivíduos com deficiência de lactase;e em particular, o género Bifidobacterium foi considerado de potencial relevância. Assim, a modulação da composição da microbiota intestinal pode influenciar a sensibilidade aos produtos lácteos em indivíduos com má absorção de lactose.
Ainda que os mecanismos exatos que explicam os sintomas GI relacionados com os alimentos em pacientes com SII permaneçam pouco claros, mas sabe-se que diferentes ajustes dietéticos melhoram os sintomas GI em certos pacientes. Uma análise post-hoc de um ensaio clínico publicado anteriormente (P0786 E Colomier et al.) revelou padrões de fatores psicológicos, nutricionais e microbianos que podem prever a resposta ao tratamento tanto à dieta tradicional NICE (National Institute for Health and Care Excellence) pour le SII et au régime pauvre en oligo-, di-, monosaccharides et polyols fermentescibles (FODMAP, Fermentable Oligo-, Di-, Monosaccharides, and Polyols) para a SII como à dieta com baixo teor de Oligo-, Di-, Monossacarídeos e Polióis Fermentáveis (FODMAP) para sintomas específicos. Isto indica que será possível, num futuro próximo, a personalização individual dos conselhos de tratamento dietético na SII.
Os micróbios intestinais e os seus metabolitos estão envolvidos na fisiopatologia de uma série de doenças intestinais, incluindo a SII e a DII, com vários resumos na semana UEG 2020 a destacar este facto. Na DII, um grande estudo de coorte confirmou a presença de disbiose intestinal tanto na colite ulcerosa (CU) como na doença de Crohn (DC) (OP002 A Vich Vila et al.), e que se traduzno perfil metabólico fecal, que pode ser utilizado como um potencial biomarcador para distinguir entre DII e não DII e entre CU e DC. Especificamente, os metabolitos relacionados com a síntese de esfingolipídos foram aumentados na DII, enquanto que os metabolitos de ácidos gordos foram diminuídos. Além disso, num estudo de prova de conceito (OP045 L Oliver et al.), uma combinação de quatro marcadores de microbioma (Faecalibacterium prausnitzii e um dos seus fitologrupos (PHG-II), Ruminococcus sp. e Methanobrevibacter smithii) podem prever a resposta do tratamento ao anti-TNF com um valor preditivo positivo de 100% e um valor preditivo negativo de 75%. Deste modo, as análises do microbioma podem ser utilizadas para personalizar o tratamento na DII futuramente. O papel da microbiota intestinal na SII foi destacado em vários resumos, incluindo um estudo de apoio aos bons efeitos a longo prazo do transplante microbiano fecal na SII (OP059 M El-Salhy et al.), e está associado a alterações no perfil bacteriano fecal e de ácidos gordos de cadeia curta e a aumento das células enteroendócrinas (P0783 M El Salhy et al.). Além disso, outro estudo demonstrou um perfil microambiental intestinal distinto na SII com uma ligação ao hábito intestinal predominante do paciente (P0651 C Iribarren et al.), com a separação entre a SII e a saúde e entre os subtipos de SII (SII com diarreia versus SII com prisão de ventre) sendo na sua maioria impulsionada por metabolitos envolvidos, por exemplo, no metabolismo de aminoácidos e em determinadas funções celulares e moleculares. O papel que os micróbios desempenham parece ser mais importante do que a composição em si. Discutiram-se modelos animais de relevância para a fisiopatologia da SII. Osestudos destacaram a importância da microbiota intestinal para o desenvolvimento de interações anormais cérebro- intestino (P0052 M Constante et al.), bem como o papel do stress na indução de disbiose intestinal e hipersensibilidade visceral (OP056 C Petitfils et al.). Estes estudos são de grande relevância para a nossa compreensão das interações intestino-cérebro na SII e do papel dos micróbios intestinais e dos seus metabolitos nestas interações, enquadrando- se o conceito de que a SII e outros distúrbios GI funcionais são agora chamados distúrbios das interações intestino- cérebro.
A MICROBIOTA NAS DOENÇAS EXTRAINTESTINAIS
Por último, outros estudos focados no microbioma intestinal e em doenças extraintestinais foram analisados. Demosntrou- se que as alterações do microbioma intestinal tanto em recetores de transplante renal como hepático (OP180 JC Swarte et al. et OP112 y Li et al.). Os pacientes com doença renal em fase terminal caracterizavam-se por uma baixa diversidade microbiana intestinal, aumento dos fatores de virulência e genes de resistência aos antibióticos. A diversidade microbiana diminuiu ainda mais após o transplante renal e a composição da microbiota intestinal não sendo restaurada. Além disso, os imunossupressores tiveram um efeito profundo na composição da microbiota intestinal. Os autores admitiram que estas alterações poderiam ter implicações de grande alcance para o resultado do transplante renal. Conclusões semelhantes relativas à diversidade microbiana, composição da microbiota intestinal e efeito dos agentes imunossupressores também foram observadas nos recetores de transplante hepático, e de forma intrigante, a diversidade microbiana foi associada à sobrevivência pós transplante hepático, revelando, por conseguinte, um novo potencial biomarcador ou alvo terapêutico.
Em jeito de conclusão e com base nos resumos apresentados na semana UEG 2020 é óbvio que o microbioma intestinal tem uma grande importância nos vários estados patológicos: desde a saúde à doença.. Para uma melhor compreensão do papel dos micróbios intestinais e dos seus metabolitos nas várias doenças, e a influência substancialmente dos cuidados de saúde hoje em dia e num futuro próximo, esta evidênciafará ainda mais sentido.