¿Qué se sabe ya sobre este tema?
El número de niños con alergias alimentarias aumenta con rapidez, y actualmente representa el 28% de los niños americanos de entre 1 y 5 años. Es posible que el desarrollo de la microbiota intestinal (MI) durante los primeros meses de vida esté implicada en esta sensibilización a los alérgenos alimentarios [2]. Numerosos factores influyen en el establecimiento de la MI, como el tipo de parto (por cesárea o vaginal), el tipo de lactancia (materna o de fórmula) y la utilización de antibióticos [3, 4]. Un estudio reciente ha demostrado que la estructura de la MI varía también significativamente entre distintos grupos étnicos [5].
Además, la transferencia de MI de niños sanos a ratones protege a estos últimos de la alergia a proteínas de la leche de vaca. Una MI deficiente en lactantes jóvenes y un alto nivel de Enterobacteriaceae/Bacteroidaceae (E/B) en lactantes jóvenes y mayores son factores predictivos de sensibilización a los alérgenos alimentarios [6].
¿Cuáles son los principales resultados aportados por este estudio?
El estudio incluyó a 1422 niños de la cohorte Canadian Healthy Infant Longitudinal Development (CHILD por sus siglas en inglés), a quienes se realizaron pruebas intraepidérmicas (neumoalérgenos y alérgenos alimentarios) a la edad de 1 y 3 años. Se tomaron muestras de heces tempranas (3,5 ± 0,9 meses) y tardías (12,2 ± 0,3 meses).
La prevalencia de la atopia fue del 12% al año y del 12,8% a los 3 años, con un 9,5% y un 5,8% de sensibilización alimentaria y un 3,3% y un 10,1% de sensibilización a los neumoalérgenos al año y a los 3 años respectivamente.
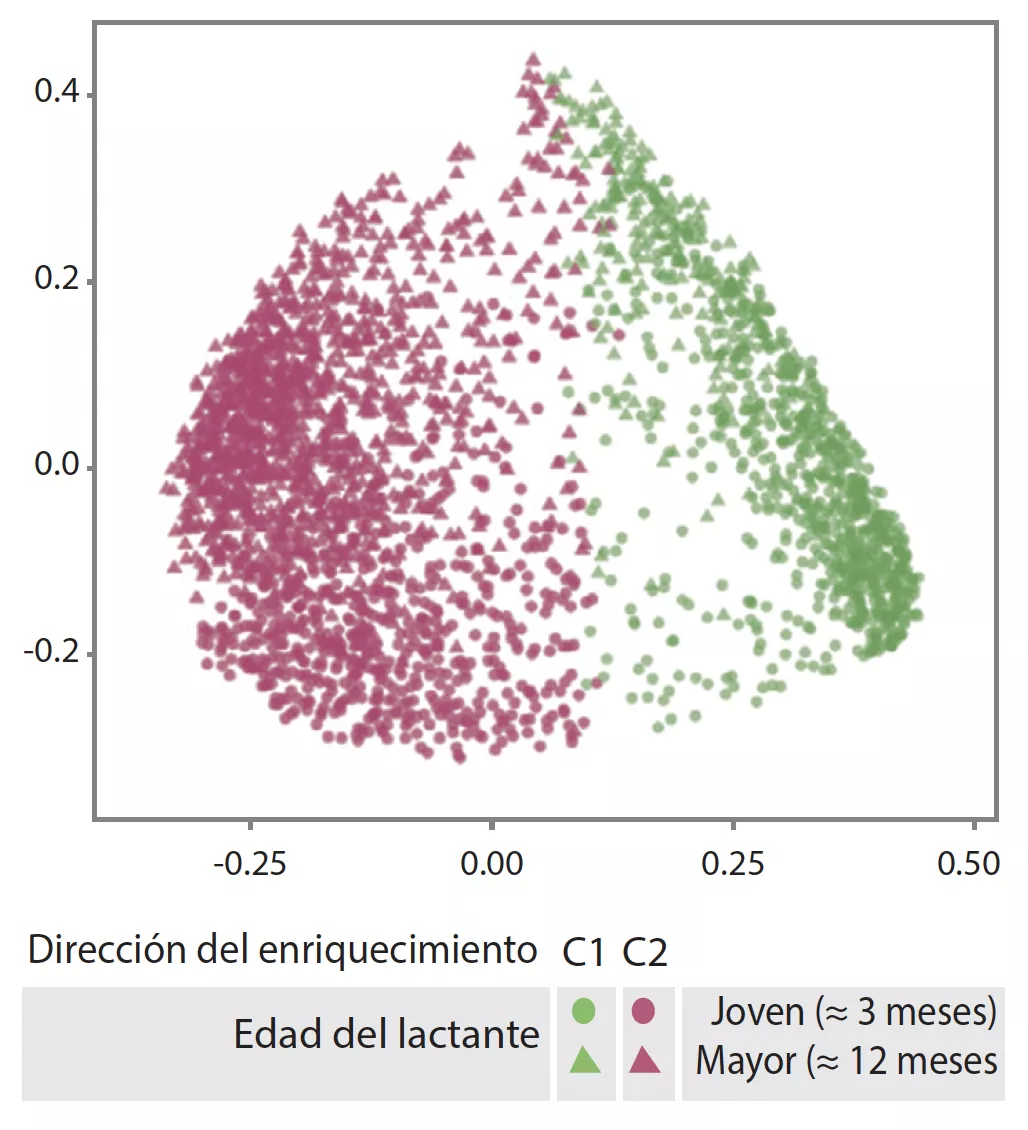
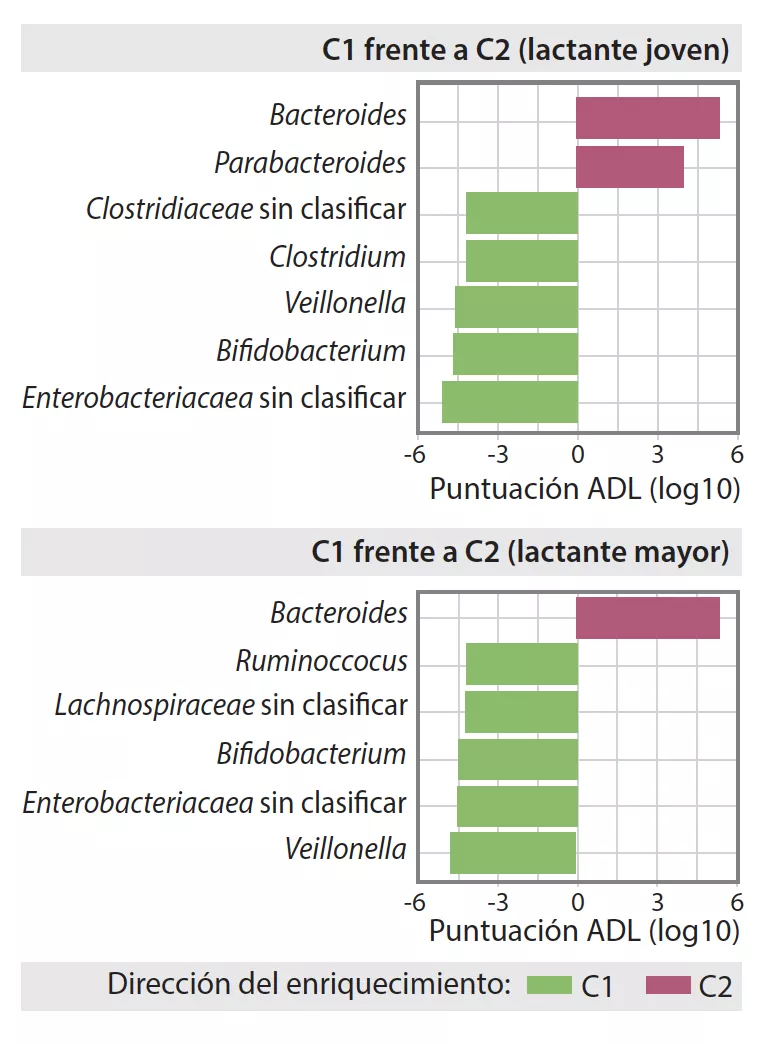
La MI tardía presentaba una diversidad beta y una variabilidad entre individuos inferiores a las de la MI temprana (p < 0,001). La MI tardía era rica en Bacteroides, Faecalibacterium, Lachnospira, Prevotella, Lachnospiraceae sin clasificar y Clostridiales sin clasificar, pero pobre en Clostridium, Veillonella, Bifidobacterium y Enterobacteriaceae sin clasificar. El análisis de los componentes principales permitió individualizar 2 agrupaciones (C1 et C2, Figura 1). C1 estaba compuesta por un 75,5% de muestras tempranas y C2 por un 63,7% de muestras tardías, las muestras tempranas y tardías de los niños nacidos por parto vaginal sin profilaxis antibiótica durante el parto eran de tipo C2, dominadas por el género Bacteroides (Figura 2).
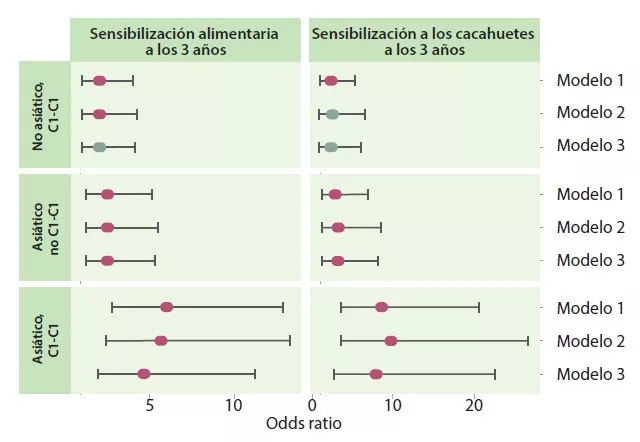
Los autores determinaron 4 trayectorias en función del tipo de agrupación temprana y tardía: C1-C1, C1-C2, C2-C1 y C2-C2. La trayectoria C1-C1 es más frecuente en lactantes asiáticos que en caucásicos (p < 0,05), así como en niños con riesgo atópico, frente a la trayectoria C2-C2 (OR 1,9; IC 95% 1,15-3,14) o C1-C2 (OR 2,38; IC 95% 1,43-3,96). Los lactantes con trayectoria C1-C1 tenían el doble de riesgo de sensibilización alimentaria a los 3 años que los de la trayectoria C2-C2 (OR 2,34; IC 95% 1,20-4,56) y C1-C2 (OR 2,60; IC 95% 1,33-5,09), en concreto a los cacahuetes (frente a C2-C2 = OR 2,82; IC 95% 1,13-6,01 y frente a C1-C2 = OR 2,01; IC 95% 0,85-4,78) (Figura 3). Los niños que no adquirieron sensibilización a los cacahuetes a los 3 años tenían un nivel más elevado de Bacteroides (p = 0,044), más bajo de Enterobacteriaceae sin clasificar (p = 0,001) y una relación E/B más baja (p = 0,013) de forma persistente a lo largo de la infancia.
La trayectoria C1-C1 de la MI actuó como mediadora del riesgo de sensibilización alimentaria y a los cacahuetes en niños de origen asiático. La asociación era fuerte incluso para los cacahuetes (OR 7,87; IC 95%: 2,75-22,55). Los lactantes de trayectoria C1-C1 presentaban colonización de C. difficile más a menudo; estos mismos niños, con la doble característica C1-C1 y colonizados con C. difficile, tenían un mayor riesgo de sensibilización alimentaria (OR 5,69; IC 95% 1,62-19,99) y a los cacahuetes (OR 5,89; IC 95% 1,16-29,87).
Por último, la microbiota de la trayectoria C1-C1 presentaba un déficit en el metabolismo de los esfingolípidos y de las funciones relacionadas con la biosíntesis de los glucoesfingolípidos.
¿Cuáles son las consecuencias en la práctica?
Este estudio permite plantearse perspectivas terapéuticas dirigidas a la MI en la alergia alimentaria de los lactantes, bien como medida preventiva, bien como medida terapéutica.

 En caso de alteración de la función renal, ¿el chocolate negro hace de barrera?
En caso de alteración de la función renal, ¿el chocolate negro hace de barrera?