Viabilidad de una función fisiopatológica de la microbiota alterada en el síndrome del intestino irritable
Síntesis
Por el prof. Jan Tack
TARGID, Universidad de Lovaina, Departamento de Gastroenterología y Hepatología, Hospitales Universitarios de Lovaina, Bélgica
52% Solo 1 persona de cada 2 que ha padecido una enfermedad digestiva que implique a la microbiota establece la relación entre las dos
El Síndrome del Intestino Irritable (SII) es un trastorno intestinal funcional habitual caracterizado por dolor abdominal, que está asociado a cambios en la frecuencia o en la consistencia de las heces. Aunque aún no se han comprobado, se han sugerido la patogénesis y una cantidad de posibles mecanismos fisiopatológicos, como: motilidad alterada, hipersensibilidad visceral, inflamación de baja intensidad, microbiota alterada, activación de la respuesta inmunitaria, reacciones adversas a alimentos y disfunción del sistema nervioso central, etc. En 2017, se publicaron en Gut cinco posibles criterios para los mecanismos de los trastornos funcionales gastrointestinales. Aquí, analizamos hasta qué punto la microbiota intestinal alterada cumple estos criterios de viabilidad en el contexto del SII y revisamos la bibliografía sobre el tema.
Introducción
El Síndrome del Intestino Irritable (SII), el trastorno intestinal funcional más común, se caracteriza por un dolor o incomodidad abdominal y está asociado a cambios en la frecuencia o en la consistencia de las heces, sin anormalidades estructurales o bioquímicas identificables que apunten a una enfermedad orgánica durante las exploraciones complementarias rutinarias [1, 2]. Además del dolor abdominal, los pacientes refieren otros síntomas gastrointestinales como meteorismo, distensión abdominal y flatulencia. El SII se puede dividir en distintos subtipos, según la consistencia más dominante de las heces: SII-C (estreñimiento predominante), SII-D (diarrea predominante) y SII-M (hábitos intestinales mixtos). En relación a la fisiopatología, el SII se considera un trastorno heterogéneo en el que se ven implicados distintos mecanismos, como una motilidad gastrointestinal alterada, una hipersensibilidad visceral, la disfunción del eje cerebro-intestino y, más recientemente, cambios en la composición y manipulación de las sales biliares, inflamación de baja intensidad, activación inmunitaria de la mucosa y microbiota intestinal alterada [3].
En la última década se ha observado un aumento significativo del interés sobre la función de la microbiota intestinal en el SII. La comunidad microbiana del intestino se ocupa de numerosas funciones, como el metabolismo de los polisacáridos indigeribles, la absorción de ciertos nutrientes y iones, la absorción y la deposición de lípidos alimenticios, la regulación del metabolismo del ácido biliar y la producción de vitaminas como el folato, la biotina y la vitamina K [3, 4]. Al competir con patógenos microbianos, refuerza la protección de la barrera gastrointestinal. Además de interactuar de forma intensa con la mucosa, la microbiota intestinal también afecta al sistema inmunitario y a la transmisión de señales intestino-cerebro del anfitrión [5]. Estas distintas propiedades señalan que la microbiota es un posible factor contribuyente mayor a la fisiopatología y una diana terapéutica interesante para el tratamiento del SII.
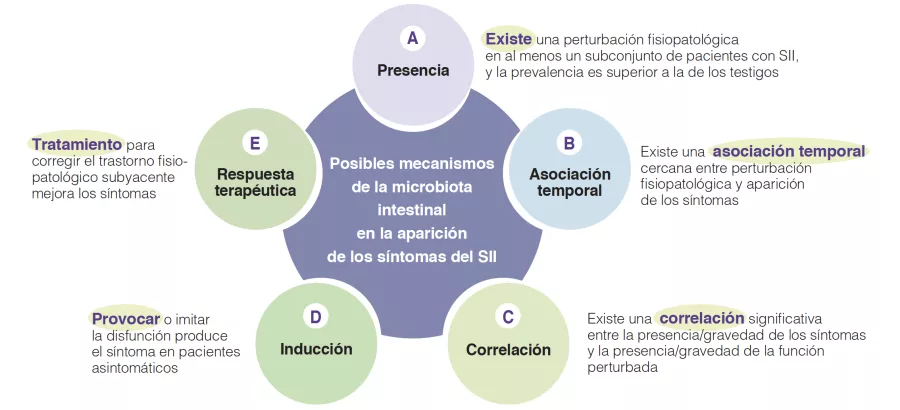
De hecho, en estudios fisiopatológicos del SII se han identificado múltiples mecanismos asociados al ecosistema microbiano intestinal. Han dado lugar a debates y observaciones variables que respaldan la relevancia de estos mecanismos candidatos individuales. Para avanzar en este campo es necesario identificar el nivel de relevancia de dichos posibles procesos fisiopatológicos, ya que esto mejoraría el conocimiento que se tiene y permitiría priorizar objetivos para la innovación u optimización terapéutica. Hace unos años, un grupo de expertos internacionales desarrolló cinco criterios de viabilidad para los mecanismos de los trastornos gastrointestinales funcionales como el SII [6]. Se basan en aspectos como la presencia, la asociación temporal, la correlación entre el nivel de afectación y gravedad del síntoma, la inducción en individuos sanos y la respuesta al tratamiento (o la evolución espontánea consecuente si no es posible el tratamiento) (Figura 1). En los apartados siguientes se evaluarán las hipótesis posibles que implican un cambio en la microbiota intestinal como un mecanismo en la aparición y presentación de los síntomas del SII (Tabla 1). Se resumen los conocimientos actuales sobre la microbiota intestinal en el SII y se identifican las áreas de investigación en el futuro.
Figura 1
Criterios de viabilidad para los mecanismos fisiopatológicos en trastornos del SII basados en una publicación de consenso [6], que pueden aplicarse a la función de los mecanismos microbianos intestinales en la patogénesis de los síntomas del SII.
Viabilidad de una función fisiopatológica para la microbiota intestinal en el SII
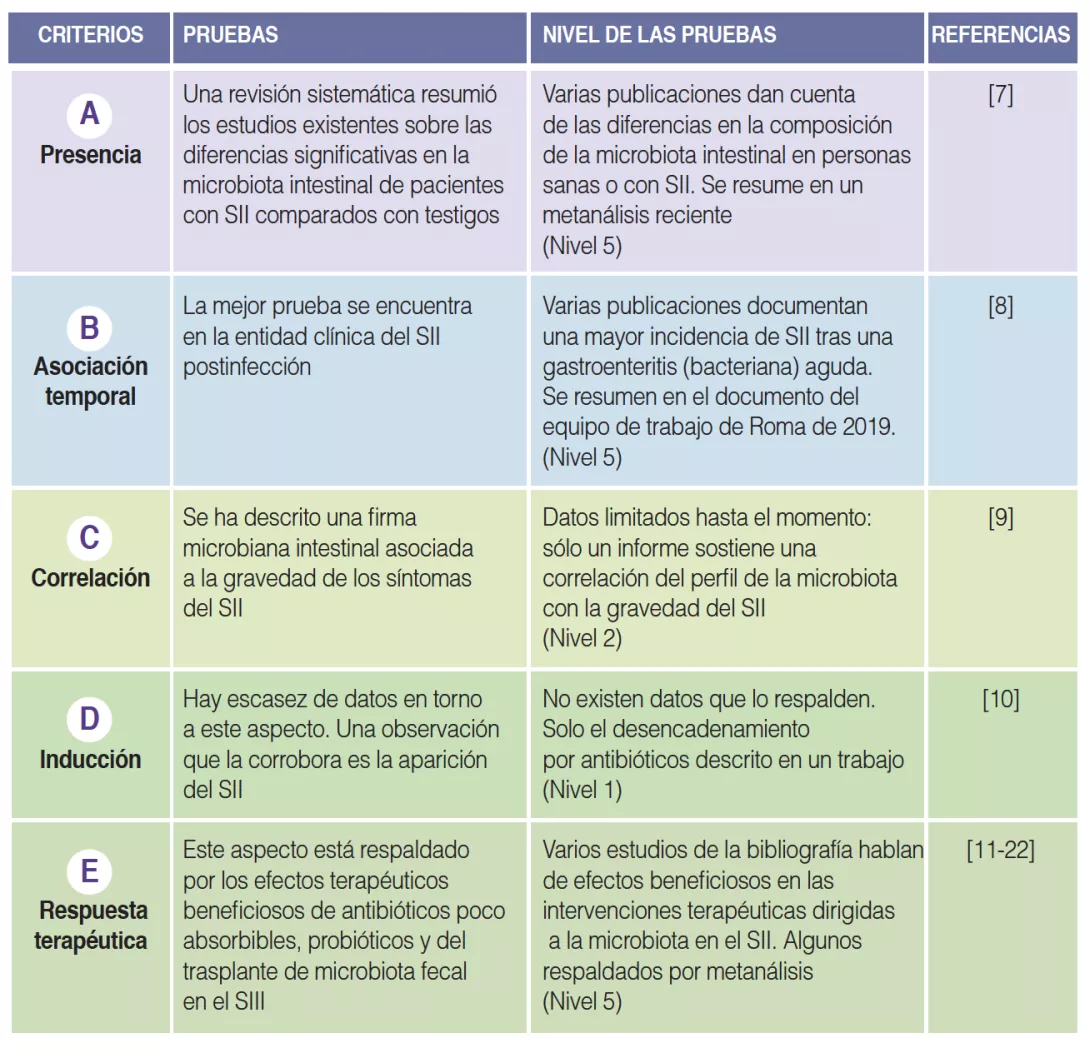
Presencia de microbiota intestinal alterada en el SII (A)
El primer criterio de viabilidad es que los cambios en la microbiota intestinal se encuentren en, al menos, un subconjunto de pacientes con SII [6]. Numerosos estudios han investigado la presencia y el tipo de alteraciones de la microbiota intestinal en el SII frente a testigos sanos. En 2019, Pittayanon y colaboradores publicaron una revisión sistemática de 24 estudios en 22 Figura 1 Criterios de viabilidad para los mecanismos fisiopatológicos en trastornos del SII basados en una publicación de consenso [6], que pueden aplicarse a la función de los mecanismos microbianos intestinales en la patogénesis de los síntomas del SII. Presencia Inducción Correlación Respuesta terapéutica Asociación temporal Posibles mecanismos de la microbiota intestinal en la aparición de los síntomas del SII A D C E B Existe una perturbación fisiopatológica en al menos un subconjunto de pacientes con SII, y la prevalencia es superior a la de los testigos Existe una asociación temporal cercana entre perturbación fisiopatológica y aparición de los síntomas Existe una correlación significativa entre la presencia/gravedad de los síntomas y la presencia/gravedad de la función perturbada Provocar o imitar la disfunción produce el síntoma en pacientes asintomáticos Tratamiento para corregir el trastorno fisiopatológico subyacente mejora los síntomas publicaciones en los que se comparaba la microbiota intestinal de pacientes con SII (principalmente adultos) con la microbiota de personas sanas [7]. Llegaron a la conclusión de que la familia Enterobacteriaceae, la familia Lactobacillaceae y el género Bacteroides habían aumentado, mientras que Clostridiales I, el género Faecalibacterium y el género Bifidobacterium habían disminuido en pacientes con SII frente a testigos sanos [7]. Si bien estas observaciones respaldan la existencia de una microbiota alterada en el SII, existe una importante heterogeneidad en los hallazgos entre distintos estudios, el tamaño de las muestras suele ser pequeño y la mayoría de los estudios se realizaron en atención especializada. Es más, muchos estudios no corrigieron las estadísticas en los análisis múltiples y no tuvieron en cuenta factores alimenticios y un eventual consumo previo de probióticos o antibióticos. Además, no se hallaron diferencias sistemáticas entre los subtipos de heces SII [7]. Sigue sin estar clara la proporción de pacientes con SII en los que se puede observar una composición de la microbiota intestinal alterada.
Asociación temporal de microbiota intestinal alterada con síntomas de SII (B)
La mejor prueba de una asociación temporal entre los cambios en la microbiota intestinal y los síntomas del SII se puede extraer de la entidad clínica del SII postinfección (PI) [8]. Aproximadamente el 10% de los pacientes con enteritis infecciosa padece SII-PI, siendo factores de riesgo el sexo femenino, una edad temprana, un malestar psíquico en el momento de la gastroenteritis y la gravedad de la infección aguda. El desarrollo del SII-PI se asocia a cambios en el microbioma intestinal, así como a alteraciones de la mucosa (inflamación de baja intensidad, hiperplasia de las células entero-endocrinas) [8]. Sin embargo, los cambios de la microbiota en el SII-PI parecen diferir de los descritos en el SII de los pacientes en general.
Correlación entre el nivel de modificación de la microbiota intestinal y la gravedad de los síntomas del SII (C)
Muy pocos estudios han intentado correlacionar la gravedad de los síntomas del SII con el grado de modificación de la composición de la microbiota intestinal, también conocida como «disbiosis». La mayoría de ellos no han logrado identificar correlaciones significativas entre las diferencias en la abundancia o en la composición de la microbiota fecal y en la gravedad de los síntomas del SII [7, 9]. En un amplio subconjunto de pacientes con SII, el grupo de Gotemburgo utilizó el aprendizaje automático para reconocer una firma microbiana intestinal capaz de predecir la gravedad de los síntomas del SII [9], lo que sugiere una relación cuantitativa entre las alteraciones de la microbiota intestinal y la gravedad del SII. Sin embargo, se necesita la confirmación de otros estudios, que quizá deberían incluir muestras de pacientes que no sean de atención especializada, donde la variación en la gravedad de los síntomas pueda ser mayor.
Inducción de los síntomas del SII en personas sanas mediante cambios en la microbiota intestinal (D)
El cuarto criterio de viabilidad, según se describe en el artículo inicial [6], es uno de los más difíciles de cumplir. Existen muy pocos datos adecuados para los diferentes mecanismos fisiopatológicos candidatos, y esto se aplica también a las alteraciones de la microbiota intestinal como mecanismo. La observación más clara se deriva de la aparición del SII tras el tratamiento de una infección no gastrointestinal con antibióticos sistémicos [10]. Todavía se desconoce la naturaleza de la alteración de la microbiota intestinal tras los antibióticos, así como el grado de similitud con la microbiota intestinal en el SII.
Respuesta al tratamiento dirigido a la composición de la microbiota intestinal (E)
Este apartado es el más estudiado a la hora de evaluar los criterios de viabilidad de una composición alterada de la microbiota intestinal como mecanismo fisiopatológico en el SII. Varios indicios apuntan al efecto terapéutico beneficioso de antibióticos poco absorbibles, claramente dirigidos a la microbiota intestinal [11, 12]. Dos estudios con neomicina y cinco ensayos con rifaximina demostraron la eficacia de estos antibióticos de amplio espectro poco absorbibles en pacientes con SII no estreñidos [11, 14]. Además, un ensayo que evaluó la seguridad y la eficacia de repetir el tratamiento con rifaximina confirmó asimismo la viabilidad de esta terapia ante la reaparición de los síntomas [15].
Los probióticos se definen como preparaciones con microrganismos vivos que aportan un beneficio para la salud del anfitrión cuando se administran en cantidades adecuadas. Varios metanálisis confirmaron la eficacia de los probióticos, como grupo, para mejorar los síntomas del SII [11, 16]. Sin embargo, la heterogeneidad de los diseños y de los criterios de valoración del estudio, así como la relativa escasez de estudios con tipos específicos de probióticos impiden llegar a conclusiones sólidas con respecto a preparaciones individuales. Por el contrario, los prebióticos, sustratos que son utilizados de forma selectiva por los microorganismos del anfitrión y que le aportan un beneficio para la salud, no mostraron eficacia alguna en la mejora de los síntomas del SII, según los metanálisis recientes [11, 17].
Probablemente, el trasplante de microbiota fecal es la forma más directa de actuar sobre la microbiota intestinal para controlar los síntomas del SII [18]. Los estudios realizados hasta la fecha han ofrecido resultados de lo más variables, desde la ausencia de efectos hasta beneficios sintomáticos, pero también el empeoramiento de los síntomas, lo que ha generado conclusiones contradictorias en metanálisis [19, 20]. Sin embargo, estudios recientes han demostrado que los cambios en la composición de la microbiota intestinal producidos por el TMF se asocian con un beneficio (transitorio) sintomático, y han señalado que la selección del donante es un aspecto decisivo [21, 22].
TABLA 1
Resumen del cumplimiento de los criterios de verosimilitud para la microbiota intestinal alterada en el SII.
Aspectos sin resolver y futuros estudios
En conjunto, los cambios en la composición de la microbiota intestinal parecen cumplir los criterios de viabilidad de relevancia fisiopatológica en el síndrome del intestino irritable [6]. Los hallazgos se resumen en la Figura 2. Sin embargo, hay una clara necesidad de continuar desarrollando los conocimientos y la investigación. Se necesitan más estudios cuantitativos y mejor controlados para caracterizar la microbiota intestinal en el SII y se necesitan testigos que, preferiblemente, deberían incluir también a cohortes grandes de pacientes de atención primaria. Esto permitirá comprender mejor los cambios de la microbiota intestinal en el SII en todos los niveles de atención, y tiene el potencial de confirmar una correlación entre la magnitud de los cambios en la composición de la microbiota intestinal y la gravedad de los síntomas del SII. Además, se necesitarán estudios longitudinales en el SII para seguir determinando la relación temporal entre los cambios en la microbiota intestinal y el patrón y la gravedad de los síntomas a lo largo del tiempo, dentro o fuera del marco de un ensayo de tratamiento.
Sigue siendo necesario realizar ensayos con probióticos de mayor calidad para el SII, con duraciones de tratamiento adecuadas y criterios de valoración validados, similares a los realizados con agentes farmacológicos. Por último, se esperan muchos datos nuevos sobre el uso del TMF en el SII, que potencialmente aclararán las mejores modalidades y la eficacia de esta opción de tratamiento.
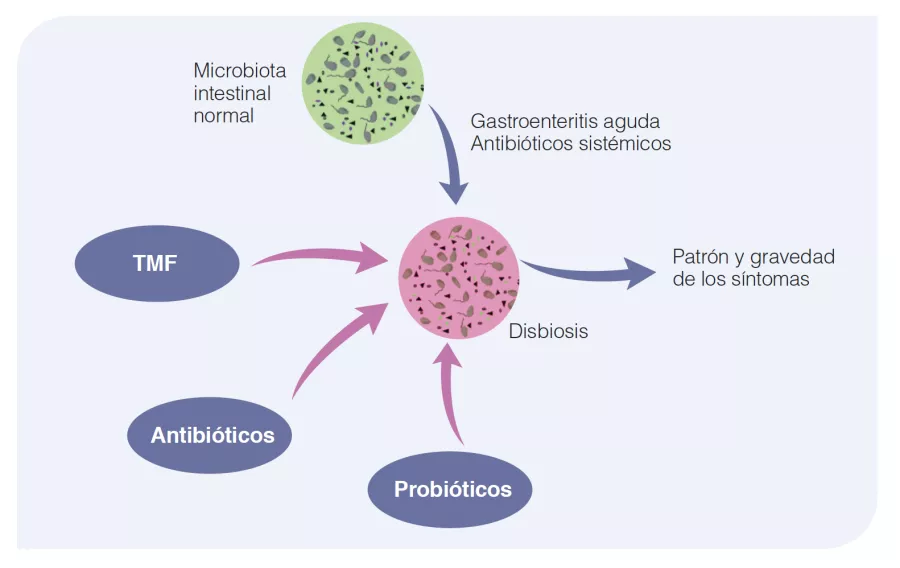
Figura 2
Relevancia fisiopatológica de los cambios en la microbiota intestinal el síndrome del intestino irritable.
La composición normal de la microbiota refleja el estado de salud, sin síntomas de SII. Procesos agudos, como una gastroenteritis aguda o la toma de antibióticos sistémicos puede alterar la composición de la microbiota del intestino y provocar síntomas de SII. Esto puede corregirse con terapéuticamente utilizando antibióticos no absorbibles, probióticos o trasplante de microbiota fecal.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016; 150: 1393-407.e5.
2 Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroenterology 2006; 130:1480-91.
3 Bonfrate L, Tack J, Grattagliano I, et al. Microbiota in health and irritable bowel syndrome: current knowledge, perspectives and therapeutic options. Scand J Gastroenterol 2013; 48: 995-1009.
4 Bajaj JS, Barbara G, DuPont HL, et al. New concepts on intestinal microbiota and the role of the non-absorbable antibiotics with special reference to rifaximin in digestive diseases. Dig Liver Dis 2018; 50: 741-9.
5 Margolis KG, Cryan JF, Mayer EA. The microbiota-gut-brain axis: from motility to mood. Gastroenterology 2021; 160: 1486-501.
6 Tack J, Corsetti M, Camilleri M, et al. Plausibility criteria for putative pathophysiological mechanisms in functional gastrointestinal disorders: a consensus of experts. Gut 2018; 67: 1425-33.
7 Pittayanon R, Lau JT, Yuan Y, et al. Microbiota in patients with irritable bowel syndrome-a systematic review. Gastroenterology 2019; 157: 97-108.
8 Barbara G, Grover M, Bercik P, et al. Rome Foundation Working Team Report on post-infection irritable bowel syndrome. Gastroenterology 2019; 156:46-58.e7.
9 Tap J, Derrien M, Törnblom H, et al. Identification of an intestinal microbiota signature associated with severity of irritable bowel syndrome. Gastroenterology 2017; 152: 111-123 e8.
10 Paula H, Grover M, Halder SL, et al. Non-enteric infections, antibiotic use, and risk of development of functional gastrointestinal disorders. Neurogastroenterol Motil 2015; 27: 1580-6.
11 Ford AC, Harris LA, Lacy BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
12 Fodor AA, Pimentel M, Chey WD, et al. Rifaximin is associated with modest, transient decreases in multiple taxa in the gut microbiota of patients with diarrhoea-predominant irritable bowel syndrome. Gut Microbes 2019;10: 22-33.
13 Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol 2000; 95: 3503-6.
14 Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. a double-blind, randomized, placebo-controlled study. Am J Gastroenterol 2003; 98, 412-9.
15 Lembo A, Pimentel M, Rao SS, et al. Repeat treatment with rifaximin is safe and effective in patients with diarrhea-predominant irritable bowel syndrome. Gastroenterology 2016; 151: 1113-21.
16 Li B, Liang L, Deng H, et al. Efficacy and safety of probiotics in irritable bowel syndrome: a systematic review and meta-analysis. Front Pharmacol 2020; 11: 332.
17 Wilson B, Rossi M, Dimidi E, et al. Prebiotics in irritable bowel syndrome and other functional bowel disorders in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2019; 109: 1098-111.
18 Goll R, Johnsen PH, Hjerde E, Diab J, Valle PC, Hilpusch F, Cavanagh JP. Effects of fecal microbiota transplantation in subjects with irritable bowel syndrome are mirrored by changes in gut microbiome. Gut Microbes 2020; 12: 1794263.
19 Myneedu K, Deoker A, Schmulson MJ, Bashashati M. Fecal microbiota transplantation in irritable bowel syndrome: A systematic review and meta-analysis. United European Gastroenterol J 2019; 7: 1033-41.
20 Ianiro G, Eusebi LH, Black CJ, Gasbarrini A, Cammarota G, Ford AC. Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2019; 50: 240-8.
21 El-Salhy M, Hatlebakk JG, Gilja OH, et al. Efficacy of faecal microbiota transplantation for patients with irritable bowel syndrome in a randomised, double-blind, placebo-controlled study. Gut 2020; 69: 859-67.
22 Holvoet T, Joossens M, Vázquez-Castellanos JF, et al. Fecal Microbiota transplantation reduces symptoms in some patients with irritable bowel syndrome with predominant abdominal bloating: short- and long-term results from a placebo-controlled randomized trial. Gastroenterology 2021; 160: 145-57.e8.