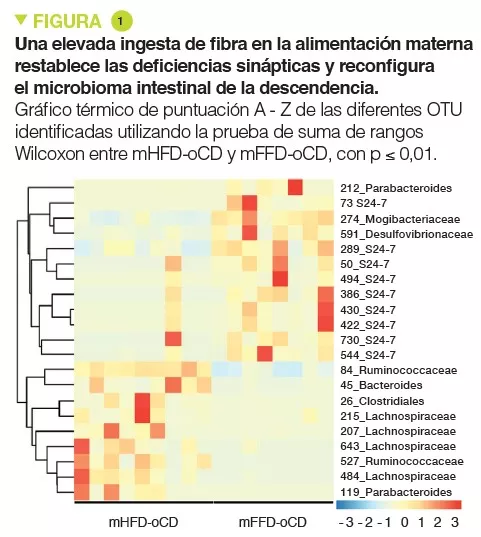
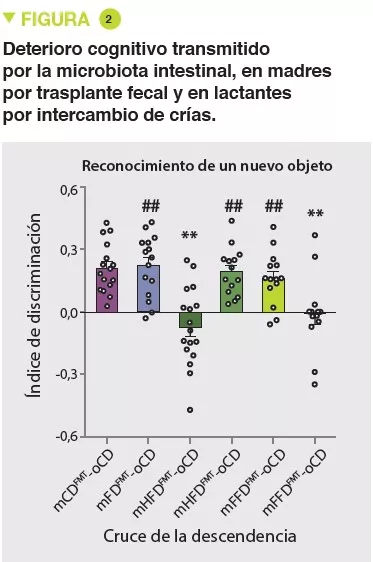
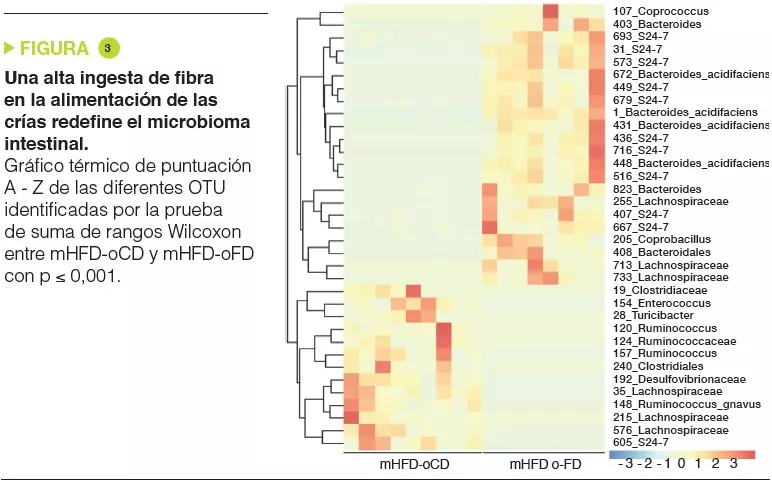
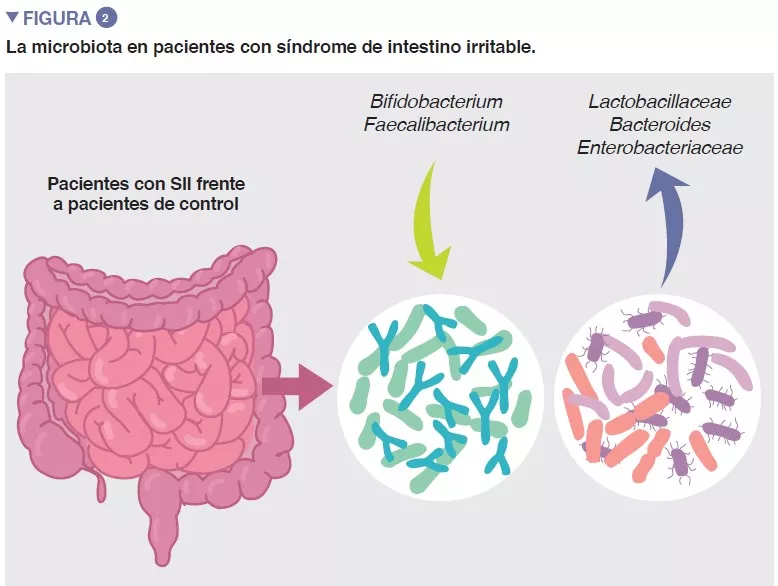
Leche humana: Papel en la colonización intestinal y la nutrición
La leche humana (LH) es el modelo de referencia para la alimentación infantil durante los primeros seis meses de vida. Permite un crecimiento y desarrollo óptimos, y debe continuarse hasta los 2 años de edad, junto con una alimentación complementaria. La LH contiene múltiples componentes bioactivos como los oligosacáridos de la leche humana (OLH) y los microorganismos (104-105 UCF) que tienen múltiples beneficios a largo y corto plazo.
Algunos estudios sugieren que la microbiota de la LH difiere de la microbiota oral, vaginal, cutánea y del meconio, con especies más cercanas entre sí, integrando una microbiota específica de la LH (Hunt KM et al. PLoS One 2011:6.e21313).
La LH configura el crecimiento y el desarrollo de la microbiota intestinal infantil desde el nacimiento hasta los 6 meses de vida. Durante este periodo se induce una programación inmunológica y metabólica ya que el perfil microbiano de bebés alimentados exclusivamente con leche materna difiere del de bebés alimentados con leche de fórmula o con una combinación entre leche materna y de fórmula.
Factores perinatales que modulan la microbiota de la LH
Mientras que la cesárea promueve la colonización con un perfil bacteriano específico, el parto vaginal conduce a un perfil parecido al de la microbiota de la madre. Algunos estudios han demostrado que la cesárea y la administración de antibióticos a la madre (resumen G-O-084) antes de la incisión cutánea inducen una colonización retardada y una microbiota menos diversa.
Además, se ha informado de la presencia de levaduras y hongos (21,4%) en la LH y se ha asociado con el uso temprano de antibióticos y una menor carga bacteriana, el ambiente exterior, la densidad de población de la ciudad, la estación del año y la atopia materna.
En un estudio transversal Zelca et al. (N-ePwP-049) examinaron las características de la microbiota gastrointestinal en lactantes (0-12 meses) y niños en edad preescolar (menores de 5 años) relacionadas con la dieta y los factores ambientales. Los autores informaron de una mayor composición de Bifidobacterium en el grupo de lactantes cuyas madres no recibieron antibióticos durante el embarazo o que tenían hermanos, y de una mayor cantidad de Bacteroides, Blautia y Ruminococcus en los niños preescolares.
OLH y bióticos
En un estudio, Kawata MS, (N-ePwP-042) utilizando un simulador del ecosistema del intestino humano analizó el impacto de una leche de fórmula enriquecida con 2 OLH [2’ fucosilactosa (Nnt; 05.g/L)] en la microbiota y los metabolitos. El autor observó un aumento de los taxones de Actinobacterias y Firmicutes, principalmente Bifidobacterium y Lactobacillus; ácidos grasos cortos como butirato, acetato y, propionato y reducción de Enterobacteriaceae spp.
Los OLH son específicos de Bifidobacterium spp., mientras que la combinación de ambos podría tener un efecto metabólico, produciendo ácidos grasos de cadena corta similares a los contenidos en la LH (Walsh C. et al, N-eP-133).
Las implicaciones futuras de la comprensión de la colonización intestinal temprana del lactante durante los primeros 6 meses y los factores de riesgo que podrían modificar la programación inmunitaria permitirán generar nuevas intervenciones terapéuticas.