¿Ha oído hablar de la «disbiosis»?
La disbiosis consiste en la ruptura del delicado equilibrio entre los miles de millones de microorganismos que conforman la microbiota humana y su relación con nuestro cuerpo. Genética, alimentación poco equilibrada, antibióticos... Las causas de la disbiosis son variadas y, en su mayoría, múltiples. Actualmente, la investigación científica ha demostrado que la disbiosis de la microbiota intestinal, la más estudiada, así como también de otras microbiotas, como la vaginal, la cutánea o la pulmonar, está relacionada con diferentes enfermedades, desde el síndrome del colon irritable hasta trastornos metabólicos, como la obesidad, pasando incluso por la sinusitis crónica y el eccema. ¿Cómo puede desequilibrarse la microbiota? ¿Cuáles son las consecuencias de la disbiosis para nuestra salud? ¿Cómo podemos recuperar el equilibrio de la microbiota?
¡Se lo explicamos!

¿Qué es la disbiosis?
En primer lugar, volvamos al propio término: «disbiosis». La etimología de este término científico es muy sencilla. En griego, la palabra bios significa «vivo» y el prefijo dis- significa «malo».
La «disbiosis» puede definirse como una alteración en la composición y el funcionamiento de la microbiota. Dicha alteración viene derivada de una combinación de factores ambientales y específicos de cada persona1.
Puesto que los microorganismos colonizan todo nuestro cuerpo, la disbiosis puede observarse en múltiples lugares:
- En la microbiota intestinal: se han asociado varias enfermedades a la disbiosis intestinal, como la diarrea postantibiótica14, la gastroenteritis17, el cólico del lactante44…
- En la microbiota cutánea: la disbiosis a menudo se asocia a procesos patológicos (acné45, dermatitis atópica46).
- En la microbiota vaginal: una disbiosis vaginal se asocia a una vaginosis bacteriana1, una candidiasis47, una menor fertilidad48 o un mayor riesgo de parto prematuro1.
- En la microbiota ORL (oreja, nariz, garganta): varias enfermedades pueden asociarse a un desequilibrio de la microbiota oral, auricular o nasofaríngea.
- En la microbiota pulmonar: la disbiosis puede intervenir en la aparición de infecciones respiratorias invernales49, asma50 o fibrosis quística51.
- En la microbiota urinaria: se ha demostrado en estudios publicados hasta la fecha el papel que desempeña la microbiota urinaria en las infecciones urinarias52.
La disbiosis sobre la mesa: la microbiota intestinal
La microbiota intestinal es la principal microbiota del cuerpo humano2. Acoge al menos a 1000 especies diferentes3 de microorganismos, como bacterias, hongos y virus. El filo Firmicutes (que incluye las famosas «bacterias buenas» lactobacilos) y el filo Bacteroidetes combinados suponen entre el 70 y el 90 % de la comunidad bacteriana de nuestro intestino2-4. Nuestra microbiota también contiene actinobacterias, como bifidobacterias, conocidas por sus efectos beneficiosos. Otros microorganismos de nuestra microbiota pueden hacer que enfermemos. Estos se conocen como «posibles (sidenote: Patógeno un patógeno es un microorganismo que causa, o puede causar, una enfermedad Pirofski LA, Casadevall A. Q and A: What is a pathogen? A question that begs the point. BMC Biol. 2012 Jan 31;10:6. ) », pero son una minoría2. La disbiosis da como resultado uno o más de los siguientes fenómenos:
- Las proporciones entre estas grandes familias de bacterias cambian significativamente, en particular con una pérdida de lactobacilos y bifidobacterias5.
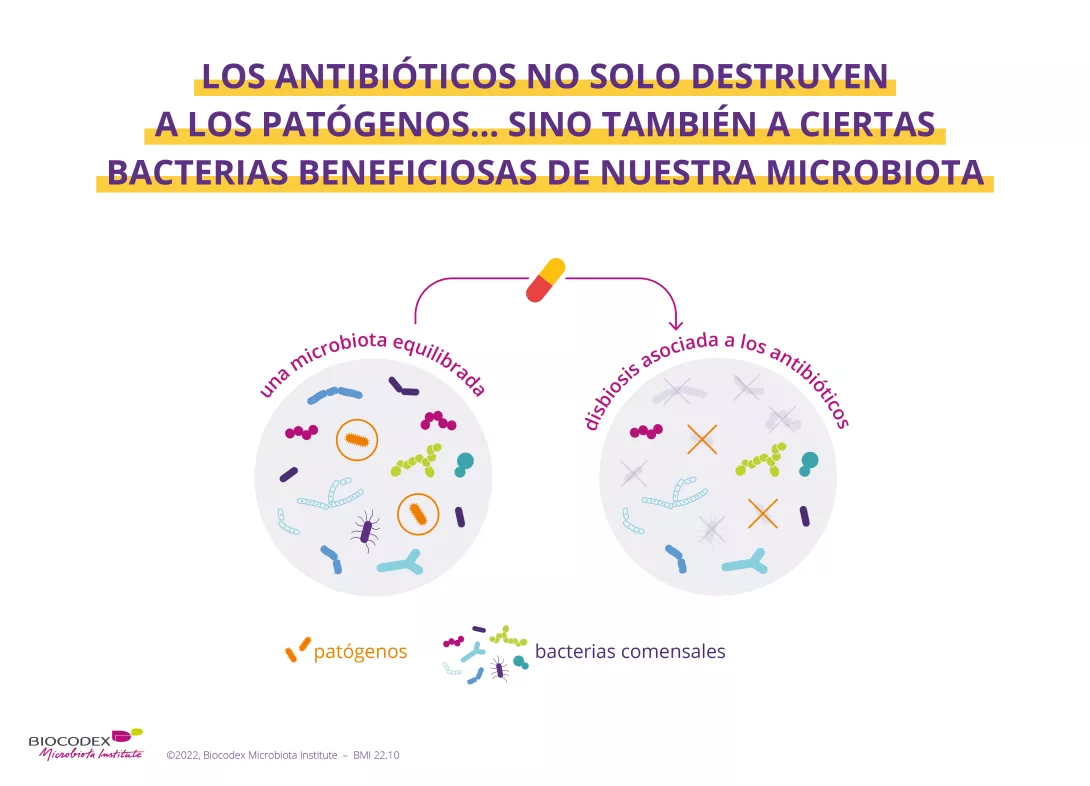
- Los microorganismos útiles que viven habitualmente en nuestra microbiota (llamados «comensales») se reducen o desaparecen1.
- La diversidad de microorganismos presentes en la microbiota se agota: hay menos especies diferentes5;
- Los microorganismos potencialmente patógenos de la microbiota se multiplican1,5.
Consecuencias: nuestra microbiota se vuelve débil y las bacterias «malas» se apoderan de las «buenas» 2. Protege nuestro cuerpo con menos facilidad contra las agresiones y cumple con menor eficacia sus funciones esenciales para mantener nuestra forma y nuestra salud.1,6.
¿Cuáles son las características de la disbiosis?
Aunque la disbiosis en sí misma no se considera una enfermedad, se ha relacionado con varios problemas de salud y puede contribuir a la aparición o el empeoramiento de ciertas afecciones.
1000 Acoge al menos a 1000 especies diferentes de microorganismos.
Desequilibrio de la microbiota específica de cada persona
Sin embargo, ¡la disbiosis no es un término universal que se pueda aplicar a todas las personas y en todas las circunstancias!1 De hecho, se ve afectada por nuestra genética y microorganismos (definición: organismos vivos que son demasiado pequeños para ser vistos a simple vista. Incluyen bacterias, virus, hongos, arqueas, protozoos, etc... Estos microorganismos, que se denominan comúnmente « (sidenote: https://microbiologysociety.org/why-microbiology-matters/what-is-microbiology.html ) »), colonizaron nuestro cuerpos durante los primeros años de vida. Asimismo, la composición de nuestra microbiota es personal. Varía tanto entre individuos que podría ser tan exclusiva como una huella digital.7 Pero también puede cambiar dependiendo de nuestra edad, nuestro estado de salud, la aparición del estrés, nuestra alimentación, el lugar donde vivimos, los medicamentos que tomamos…8 Por lo tanto, cada uno de nosotros puede tener «su» disbiosis cuando nuestra microbiota se desequilibra y no funciona correctamente en nuestro organismo.1
Entonces, ¿qué significa tener una microbiota equilibrada?
El prefijo dis de disbiosis se opone a eu («bueno») o sim («con»). Por tanto, hablamos de «eubiosis» o «simbiosis» cuando nuestra microbiota está en buen estado : interactúa en armonía con nuestro organismo y su comunidad microbiana está equilibrada.1
De hecho, existe un beneficio mutuo entre los miles de microorganismos que habitan nuestra microbiota y nuestro cuerpo.9 Todos salen ganando: el cuerpo proporciona «alimento y refugio» a los microorganismos de la microbiota. A cambio, estos participan en muchas funciones importantes de nuestro cuerpo, como la digestión, la asimilación de nutrientes, la protección de la impermeabilidad de la pared intestinal y la lucha contra gérmenes no deseados.2,8,10 ¡Es todo un trabajo en equipo!
Los diferentes microorganismos de la comunidad de nuestra microbiota, incluidos aquellos que pueden ser patógenos, están presente en número y proporciones adecuadas para convivir de manera pacífica y garantizar sus funciones beneficiosas para el organismo. Sin embargo, este sutil equilibrio entre los ecosistemas microbianos de nuestro cuerpo puede romperse: la eubiosis se transforma en disbiosis.8
¿Qué causa una disbiosis?
Tal como indica su definición, la disbiosis aparece por el efecto de varios factores muy diferentes, a menudo entrelazados.5. No obstante, podemos distinguir entre:
Aquellos que están relacionados con el propio individuo, tales como:
- La genética.1
- La edad.11
- Ciertas afecciones y lesiones. 1
Aquellos que están relacionados el entorno, tales como:
- La ingesta de medicamentos: antibióticos, antiinflamatorios...2,5
- Las infecciones.
- El estilo de vida: alimentación desequilibrada o cambios de alimentación, estrés, tabaquismo, una higiene inadecuada...1, 5,8 .
- La contaminación.8
¿Qué puede causar una disbiosis?
Los antibióticos han supuesto uno de los progresos terapéuticos más importantes del siglo XX. Tras el descubrimiento de la penicilina en 1928, se han salvado millones de vidas.13 Sin embargo, al destruir los gérmenes dañinos y también las bacterias «buenas», se desequilibra la microbiota. A corto plazo, la disbiosis generada por los antibióticos puede derivarse en diarrea14 o micosis vaginal 15. También se sospecha que la disbiosis intestinal inducida por antibióticos tiene un impacto a largo plazo, especialmente cuando se toman antibióticos durante la infancia, al aumentar el riesgo de diversas enfermedades crónicas como la obesidad o las alergias 16 ...
Durante infecciones como la gastroenteritis vírica o la intoxicación alimentaria por salmonela, los microbios dañinos y agresivos invaden la microbiota humana. No provienen de la microbiota, sino del exterior, y se transmiten, por ejemplo, por las manos o alimentos contaminados. Estas infecciones provocan una fuerte reacción de nuestro sistema inmune, una inflamación del intestino y diarrea. Todo ello provoca alteraciones bruscas en el equilibrio de nuestra flora intestinal. Además, los microbios implicados en estas infecciones también pueden promover el desarrollo de otras bacterias potencialmente patógenas ya presentes en la microbiota. Por lo tanto, las infecciones causan disbiosis, ¡de la que se benefician todas las bacterias dañinas !1,12,17,18
Lo que comemos afecta a la microbiota a lo largo de nuestra vida. Un cambio repentino en la dieta, en composición o cantidad, puede desencadenar disbiosis. Pero no solo eso: si las variaciones habituales de nuestros menús de un día para otro solo provocan modificaciones transitorias de la microbiota, nuestro tipo de alimentación puede modificar el ecosistema digestivo de manera permanente5 y puede, a largo plazo, ser un factor de disbiosis. Por tanto, los estudios sugieren que una dieta «al estilo occidental» rica en grasas, azúcares y proteínas puede provocar desequilibrios en la microbiota intestinal, mientras que una dieta variada rica en frutas y verduras podría protegerla.1,19
Antibióticos
Han salvado millones de vidas, pero su uso excesivo e inapropiado supone actualmente un grave peligro para la salud, sobre todo debido a la resistencia a los antibióticos y a la disbiosis de la microbiota. Todos los años, la OMS organiza la Semana mundial de concienciación sobre la RAM (WAAW) para aumentar la sensibilización sobre la resistencia antimicrobiana. Echemos un vistazo a esta página dedicada al tema.
Antibióticos: ¿qué impacto en la microbiota y en nuestra salud?
Cada año, desde 2015, la OMS organiza la Semana mundial de concienciación sobre la RAM (WAAW por sus siglas en inglés), cuyo objetivo es fomentar la sensibilización sobre la resistencia global antimicrobiana.
La resistencia antimicrobiana se produce cuando las bacterias, los virus, los parásitos y los hongos cambian con el tiempo y dejan de responder a los medicamentos. Debido a la resistencia a los fármacos, los antibióticos y otros medicamentos dejan de ser efectivos y las infecciones son cada vez más difíciles o incluso imposibles de tratar, lo que aumenta el riesgo de propagación de las enfermedades, de sufrir dolencias graves y de muerte.
Esta campaña, que se desarrolla del 18 al 24 de noviembre, anima al público en general, a los profesionales de la salud y a los responsables políticos a usar los antibióticos, los antivirales, los antifúngicos y los antiparasitarios con cuidado, para prevenir la aparición de nuevas resistencias antimicrobianas.
Disbiosis: ¿causa o consecuencia de una enfermedad?
Se ha demostrado en numerosos estudios que comparaban la microbiota de personas sanas con la de personas enfermas que la disbiosis está asociada a diversas afecciones crónicas: enfermedades intestinales, como el síndrome del colon irritable o la enfermedad de Crohn, así como obesidad, alergias, asma y determinados cánceres1. Pero ¿es la disbiosis la que provoca la enfermedad o es la enfermedad la que causa la disbiosis? Para los científicos, la respuesta no siempre es obvia, pero actualmente es objeto de mucha investigación.
Con el fin de arrojar luz, los investigadores lanzaron Homo symbiosus en 2019, un gran proyecto de investigación que tiene como objetivo determinar mejor por qué y cómo tantas enfermedades crónicas están relacionadas con la disbiosis intestinal. Los investigadores plantearon la hipótesis de que todos «estos fenómenos de disbiosis intestinal, proliferación de microbios, inflamación y debilitamiento de la pared intestinal» se apoyan entre sí10.
La disbiosis de la microbiota intestinal se asocia a diversas enfermedades: no solo dolencias gastrointestinales, sino también metabólicas22, alérgicas23 e incluso mentales24. No obstante, el cuerpo humano también alberga ecosistemas microbianos específicos en la piel25, las vías urinarias26, la vagina27 o la boca28 y los pulmones29, cuya composición puede desequilibrarse y relacionarse con determinadas enfermedades.
¿Cómo podemos recuperar el equilibrio de la microbiota?
Normalmente, después de un episodio de disbiosis, la microbiota es capaz de recuperar de forma natural su equilibrio inicial (aunque nunca recuperamos por completo la composición inicial): se dice que es «resiliente»30. Pero a veces esta «rebiosis», es decir, la vuelta al equilibrio microbiano, puede llevar tiempo: por ejemplo, incluso en un adulto sano, puede tardar hasta seis meses después de tomar un antibiótico31. Por último, la disbiosis a veces provoca un estado de desequilibrio que perdurará y se mantendrá en el tiempo sin poder recuperarse por completo, lo que puede ser perjudicial para la salud1.
¿Qué hacemos ante una disbiosis? Disponemos de varias soluciones para restablecer el equilibrio de la microbiota y recuperar una mejor salud.
El Observatorio Internacional de las Microbiotas
Los probióticos son «microorganismos vivos que, cuando se administran en la cantidad correcta, resultan beneficiosos para la salud del que los toma».30,31 Aquí encontrará una página sobre los probióticos, cómo funcionan, cómo se elaboran, cómo elegirlos bien... Consulte nuestra página sobre los probióticos.
Derivados principalmente de fibras alimentarias (fructooligosacáridos, galactooligosacáridos, inulina, etc.), los prebióticos son nutrientes o sustratos no digeribles, utilizados por los microorganismos de la microbiota y que tienen efectos favorables en la salud.32,33 Aquí encontrará más información sobre su forma de actuar sobre la microbiota . Los productos específicos que combinan probióticos y prebióticos se denominan simbióticos.34,35
Lo que comemos, tanto la calidad como la diversidad de nuestra alimentación, contribuye al equilibrio de nuestra microbiota intestinal38,39, pero también influirá en su composición y, a su vez, será responsable de provocar determinadas enfermedades22. ¡No dude en consultar a su médico de cabecera o nutricionista para obtener más información sobre los alimentos que tienen efectos beneficiosos o nocivos para mantener su intestino sano y en buena forma 40!
Al igual que otros órganos, la microbiota se puede trasplantar de un individuo a otro para intentar restablecer el equilibrio de su ecosistema microbiano41,42. Por el momento, este enfoque terapéutico, conocido como trasplante de microbiota fecal (TMF), está bien documentado para la microbiota intestinal; sin embargo, solo está autorizado para el tratamiento de infecciones recurrentes por Clostridioides difficile41. Es objeto de una intensa investigación para otras patologías intestinales41. Para la vagina, el trasplante de microbiota vaginal (TMV) se está sometiendo a ensayos actualmente y podría ser un tratamiento prometedor para la vaginosis bacteriana recurrente o resistente43. Los estudios sobre el trasplante de microbiota cutánea son aún poco frecuentes, pero los resultados iniciales son alentadores44,45.

"Informativo" -Peggy Rhinelander (De My health, my microbiota)
"Es absolutamente fascinante cómo la disbiosis revela las conexiones ocultas entre nuestra salud y la microbiota." -Aware Health Rewards App (De My health, my microbiota)