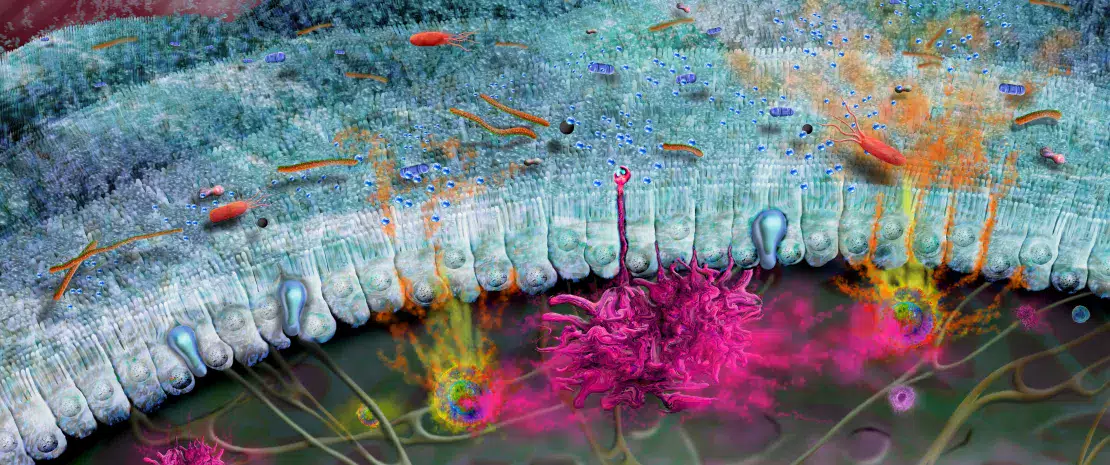
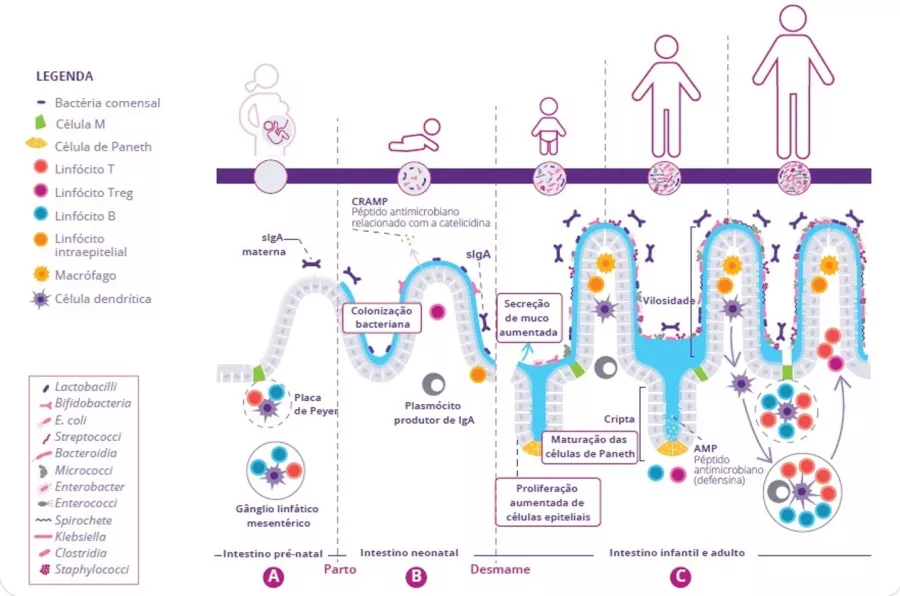
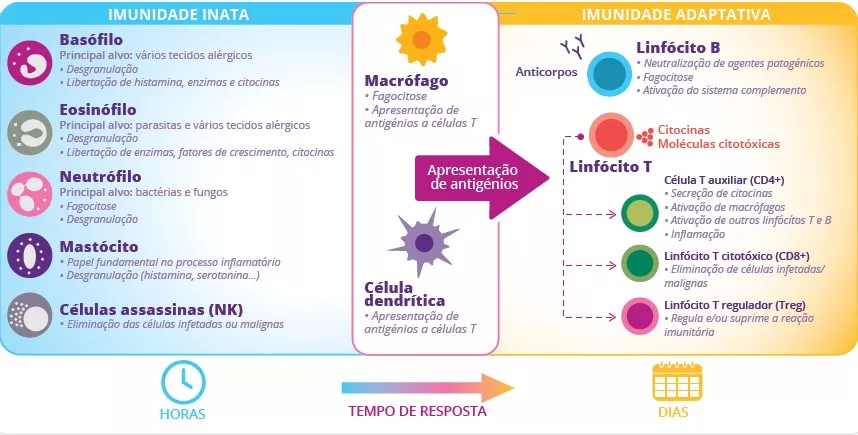
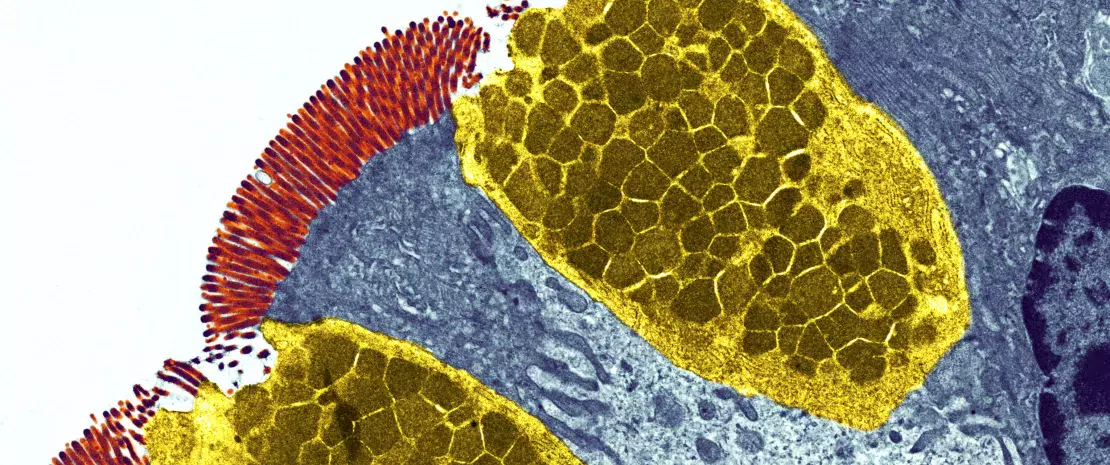
A microbiota intestinal participa na defesa dos pulmões contra as infeções respiratórias virais
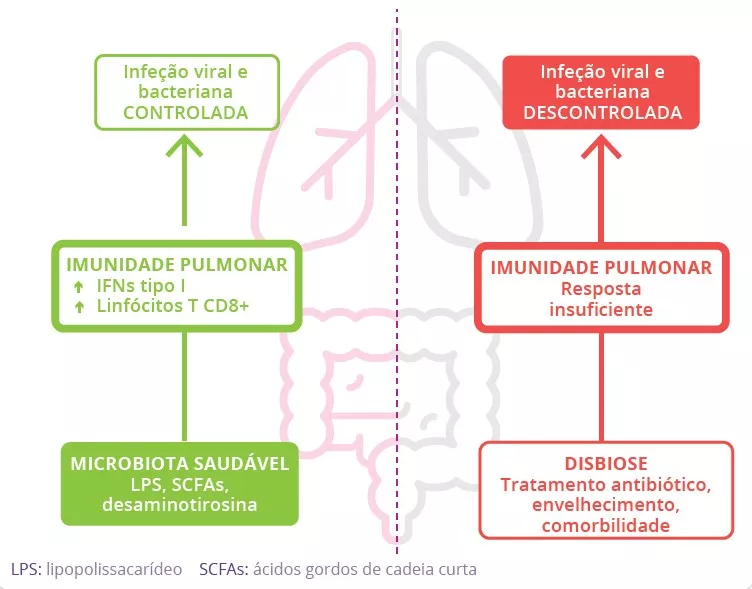
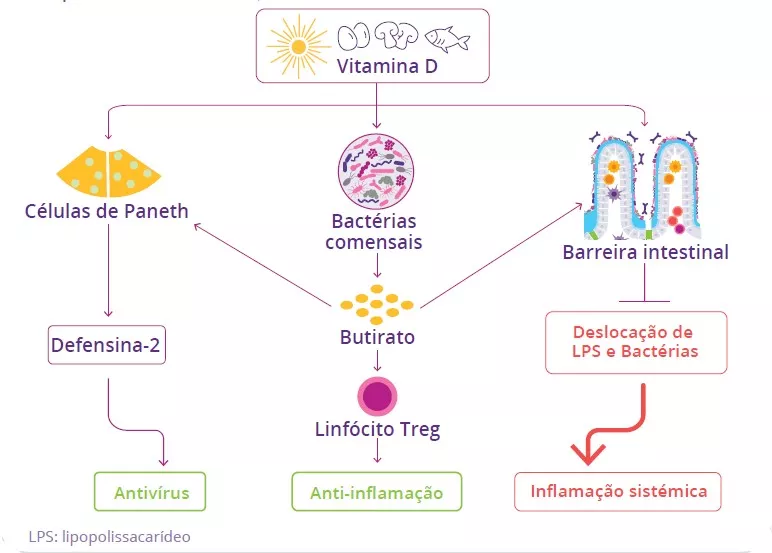
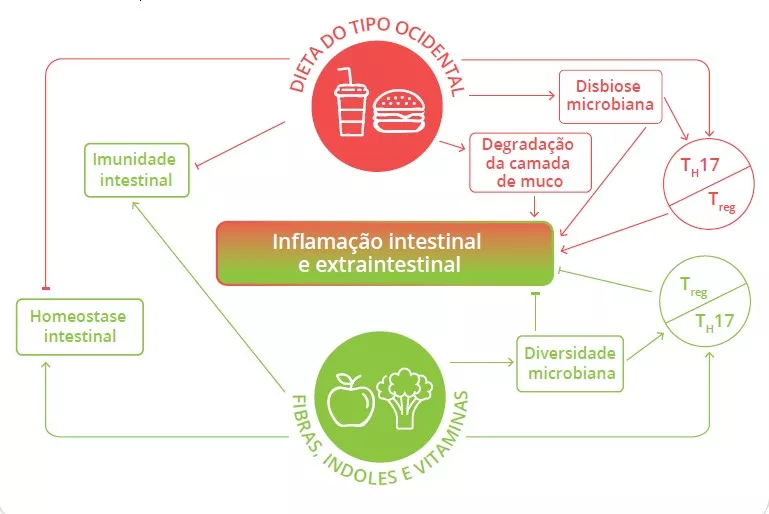
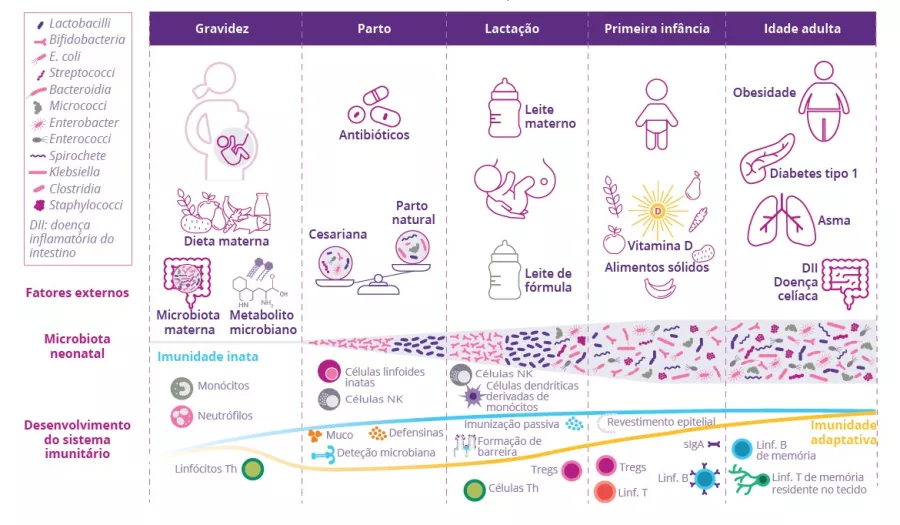
A microbiota desempenha um papel fundamental no desenvolvimento, treino e funcionamento do sistema imunitário, tanto a nível local como sistémico. Embora a microbiota das vias aéreas regule localmente a função imunitária, a microbiota intestinal pode também influenciar a imunidade respiratória, através do eixo intestino-pulmão.1 Têm-se observado alterações das microbiotas pulmonar e intestinal em muitas doenças respiratórias, não tendo, contudo, sido possível determinar ainda se a disbiose desses locais surge como causa ou consequência da doença.2 A alteração da composição da microbiota intestinal devido à dieta, ao uso de antibióticos, ao envelhecimento ou a doença, encontrase associada a respostas imunitárias alteradas e homeostase das vias aéreas,3 revelando que a microbiota intestinal pode influenciar o desenvolvimento de doenças em todo o corpo, inclusivamente quanto ao risco de infeções respiratórias (figura 6).4