Quais são os fatores causadores de surtos?
Os surtos inflamatórios podem ser desencadeados por diversos fatores, que incluem o stress, a poluição, o frio, a humidade, certos alergénios (pólenes), determinados medicamentos, roupas de lã e alguns cosméticos contendo plantas ou óleos essenciais.
O que é que sabemos sobre as relações entre a dermatite atópica, a microbiota e a imunidade?
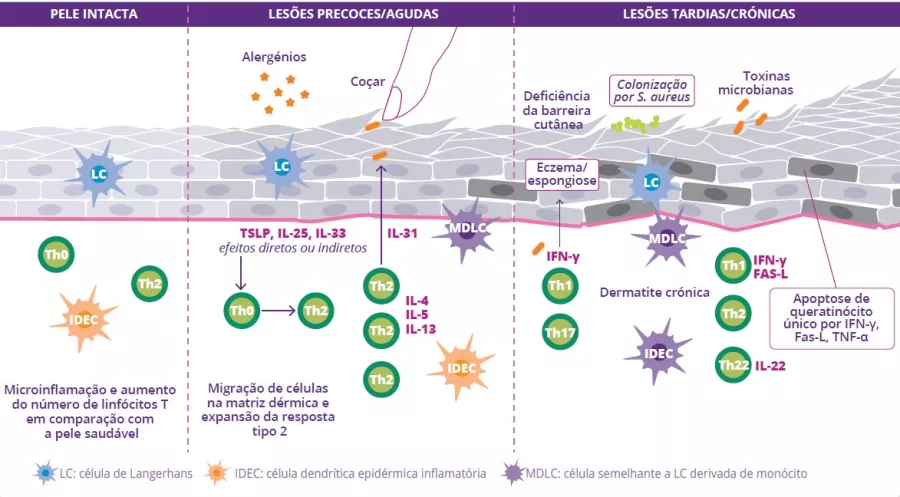
Ao nível fisiopatológico, a DA caracteriza-se por uma alteração da barreira cutânea, uma disbiose cutânea e intestinal e uma desregulação imunitária com ativação de linfócitos Th2. Essa desregulação imunitária provoca um grande aumento das citocinas, que por sua vez causa as reações inflamatórias.2
A alteração da barreira cutânea é o ponto de partida para uma disbiose da microbiota da pele caracterizada pela redução da diversidade bacteriana e pela proliferação de Staphylococcus aureus. A penetração de alergénios leva à ativação dos queratinócitos e à produção de interleucina (IL-33, IL-25, TSLP), resultando na diferenciação dos linfócitos Th2. Estes, por sua vez, segregam citocinas pró-inflamatórias (IL-4, IL-5 e IL-13) caraterísticas da inflamação de Tipo 2 (figura 9). Estas citocinas ativam diretamente os nervos sensoriais, provocando prurido.
Com lesões crónicas, a barreira cutânea repara-se de forma deficiente e torna-se mais espessa, uma vez que está sujeita a inflamação crónica. Há também um aumento progressivo de citocinas e de células Th (Th1, Th2, Th22) que segregam citocinas, as quais contribuem para a destruição dos queratinócitos. Por último, a disbiose intestinal pode desempenhar um papel no mecanismo fisiopatológico da doença.3
O que é que as recentes descobertas sobre a microbiota lhe revelaram? A sua prática clínica alterou-se?
As recentes descobertas sobre a microbiota permitiram-me compreender melhor a importância de se manter e reparar a barreira epidérmica para se controlar a inflamação. Como tratamento sistémico, aconselho os meus pacientes a usarem um gel de limpeza que preserve o pH da pele (pH ~5, são de evitar produtos com pH básico), além de um creme hidratante e de produtos cosméticos personalizados. As conclusões ajudam-nos também a perceber melhor o sistema imunitário da pele e a sabermos como respeitar a microbiota cutânea.
Qual é a sua opinião sobre a utilização de probióticos para tratar a dermatite atópica ou prevenir as recaídas?
Existem muitas formas de reequilibrar a microbiota da pele em caso de DA (probióticos, prebióticos, simbióticos, etc.)5 mas a abordagem pós-biótica parece-me ser a mais interessante. Os pós-bióticos são preparações de microrganismos inanimados e/ou respetivos elementos que são benéficas para a saúde do hospedeiro.6 Podem restaurar a barreira cutânea através de uma ação anti-inflamatória que permite a recolonização das bactérias, exercendo assim um impacto a longo prazo na microbiota. Os probióticos ou prebióticos orais são outras abordagens interessantes para regular o sistema intestinal, que por si só desempenha um papel imunomodulador geral no sistema imunitário.7