El eje intestino-pulmón en las infecciones respiratorias virales
Por la Dra. Genelle Healey
Curiosamente, durante las infecciones respiratorias se observan alteraciones de las dos microbiotas, lo que tiende a confirmar la teoría según la cual todas las mucosas están interconectadas y el eje intestino-pulmón es bidireccional.1
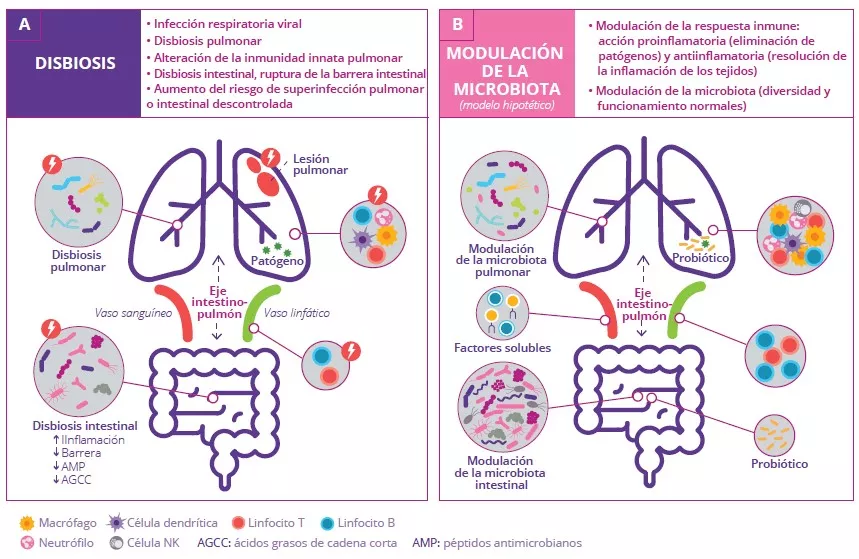
Las bacterias intestinales, sus fragmentos y los AGCC pueden atravesar la barrera intestinal y recorrer el sistema linfático mesentérico hasta llegar a la circulación general para modular las células inmunes del pulmón.11 Las infecciones gripales se caracterizan por una alteración de la microbiota y de las funciones inmunes del pulmón. Además, se observa una disbiosis intestinal que podría explicar los síntomas similares a los de la gastroenteritis que a menudo acompañan a dichas infecciones (Fig 7A).10
FIGURA 7: El eje intestino-pulmón durante la infección respiratoria viral (A) y el modelo de modulación de la microbiota con probióticos (B).
Adaptado de Dumas A et al, 20182
Los probióticos pueden ser útiles para acelerar la recuperación (homeostasis de la microbiota, control de la infección, modulación de las respuestas inmunes) por sus efectos en los metabolitos de la microbiota intestinal (AGCC, etc.) o productos derivados del huésped.
Las causas de esta disbiosis intestinal son probablemente múltiples e incluyen la pérdida de apetito (que provoca una disminución en el consumo de alimentos y calorías), así como la liberación de citocinas inflamatorias. Esto puede tener distintas consecuencias locales (inflamación intestinal, ruptura de la barrera intestinal, descenso en la producción de péptidos antimicrobianos (AMP), disminución de los AGCC) que a su vez pueden desencadenar infecciones entéricas secundarias.10
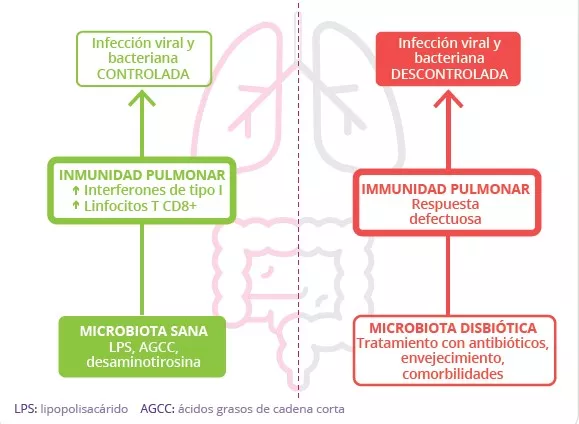
La alteración de la barrera intestinal promueve la translocación bacteriana y la liberación de endotoxinas en la sangre, lo que resulta en inflamación sistémica, agravación de las lesiones pulmonares y aumento del riesgo de contraer infecciones bacterianas secundarias.10 La disminución de la producción de AGCC por parte de la microbiota intestinal también contribuye a la reducción de la inmunidad antibacteriana que se observa en los pulmones.10 Esto subraya el papel crucial de la microbiota intestinal en la defensa del pulmón contra las infecciones respiratorias.
La modulación de la microbiota intestinal mediante estrategias como la administración de probióticos puede contribuir a reducir la susceptibilidad a las infecciones respiratorias a través del eje intestino-pulmón, o ayudar a la curación después de una infección (Fig 7B). Varios estudios en ratones demostraron que la administración de determinados probióticos antes de una infección gripal resulta en la acumulación de células inmunes en los pulmones infectados. Dichos probióticos también mejoran el aclaramiento viral y el estado de salud general, además de reducir las alteraciones de la microbiota intestinal.12,13
Recomendado por nuestra comunidad

"Bueno, soy una de las personas con problemas pulmonares (infección). Entiendo esto muy importante." -@Ahishakiyejanv2 (De Biocodex Microbiota Institute en X)