Микробиота кожи человека, которую долгое время считали в основном источником инфекции, в настоящее время признана важным фактором сохранения и поддержания здоровья организма1. Способствуя иммунной защите, iона играет ключевую роль в восстановлении тканей и выполнении барьерных функций, подавляя колонизацию или инфицирование условно-патогенными микроорганизмами2.
КАЖДОМУ УЧАСТКУ КОЖИ — СВОЯ МИКРОБИОТА
Микробиота кожи служит прибежищем миллионов бактерий, а также грибов и вирусов. Corynebacterium, Cutibacterium (ранее известные как Propionibacterium), Staphylococcus, Micrococcus, Actinomyces, Streptococcus и Prevotella являются наиболее распространенными родами бактерий на коже человека3. Однако, относительное обилие таксонов бактерий в значительной степени зависит от местной микросреды рассматриваемого участка кожи и особенно от его физиологических характеристик, то есть от того, является ли он сальным, влажным или сухим. Следовательно, липофильные виды Cutibacterium преобладают на сальных участках, в то время как виды Staphylococcus и Corynebacterium особенно многочисленны на влажных4.
ОТ ФИЗИОЛОГИИ К ПАТОЛОГИИ: АМБИВАЛЕНТНАЯ РОЛЬ C. ACNES
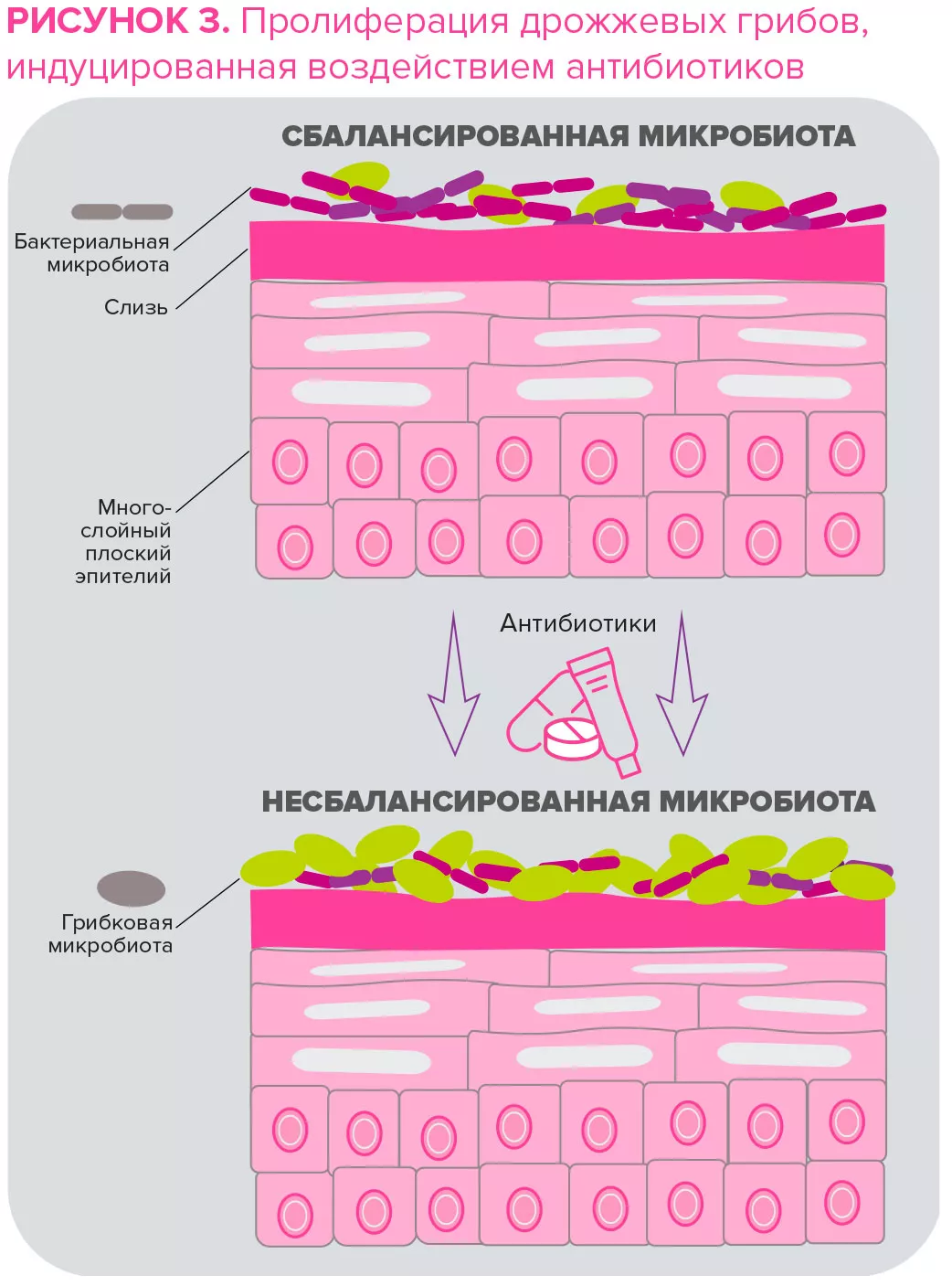
Факультативный анаэроб C. acnes является одним из наиболее распространенных бактериальных видов в микробиоме кожи. Он участвует в развитии акне — хронического воспалительного заболевания кожи со сложным патогенезом5. В отличие от прежних представлений, недавние исследования показывают, что гиперпролиферация C. acnes — не единственный фактор в возникновении акне6. Действительно, акне вызывают потеря баланса между различными штаммами C. acnes вместе с дисбиозом микробиоты кожи6. Более того, взаимодействие между S. epidermidis и C. acnes имеет решающее значение в регуляции гомеостаза кожи: S. epidermidis подавляет рост C. acnes и воспаление кожи. В свою очередь C. acnes путем секреции пропионовой кислоты, которая участвует в поддержании кислых значений рН пилосебацейных фолликулов, ингибирует развитие S. epidermidis. Malassezia, наиболее распространенный грибок кожи, также играть роль в развитии рефрактерных форм акне за счет рекрутинга иммунных клеток, хотя его роль требует дополнительного изучения6.
ЛЕЧЕНИЕ АКНЕ — ВАЖНЫЙ ИСТОЧНИК АНТИБИОТИКОРЕЗИСТЕНТНОСТИ
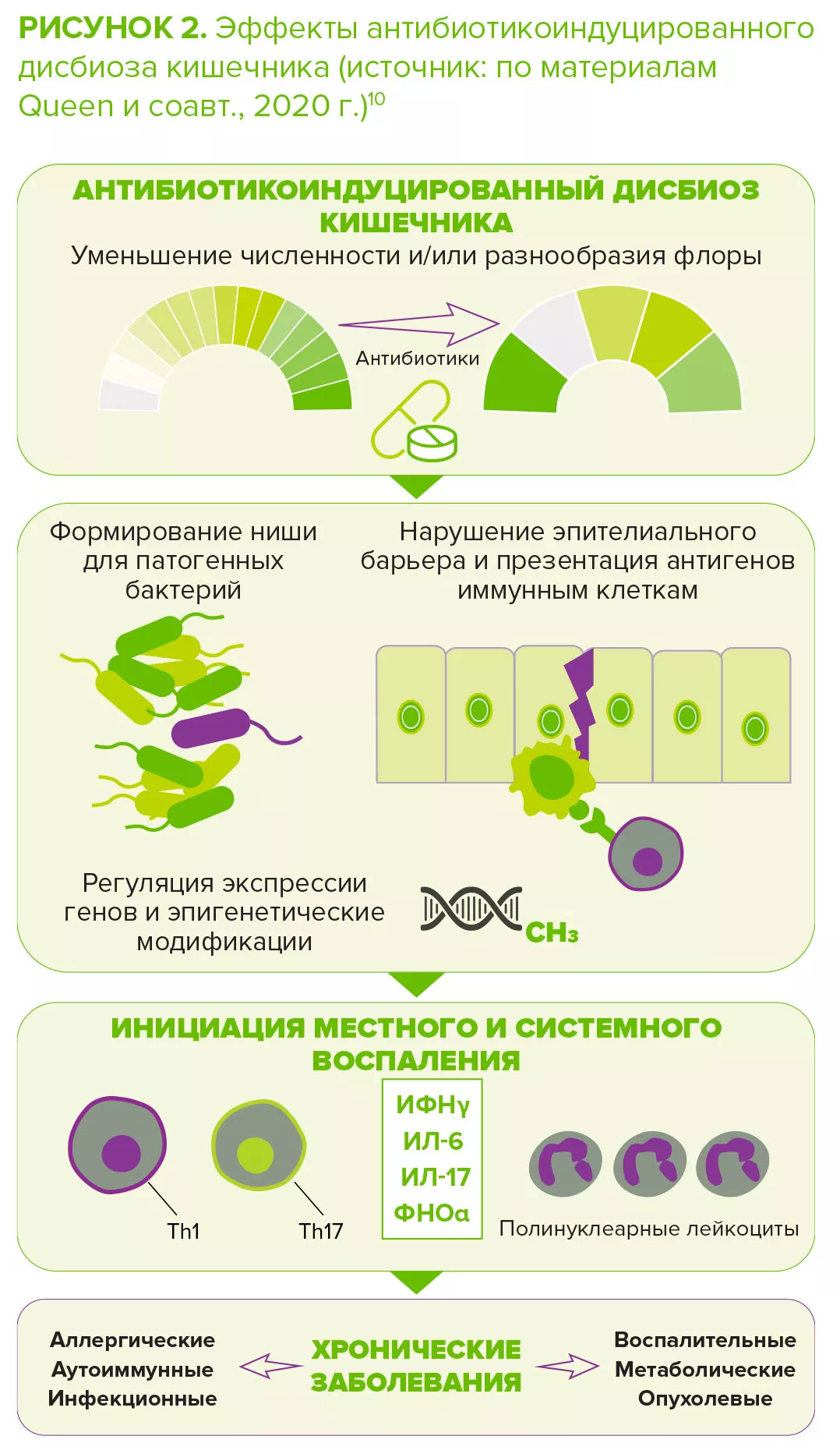
Несмотря на регулярное использование, местных и пероральных антибиотиков для лечения акне, они вызывают несколько проблем. Первой проблемой, акцентируемой экспертами, является нарушение микробиоты кожи, хотя точных данных по этому вопросу пока мало. Недавнее про- дольное исследование сравнивало микробиоту щек 20 пациентов с акне до и после шести недель пероральной терапии доксициклином. Интересно, что воздействие антибиотиков сопровождалось увеличением бактериального разнообразия. По мнению авторов, это могло быть связано с уменьшением колонизации C. acnes, которые высвобождали пространство для роста других бактерий7.
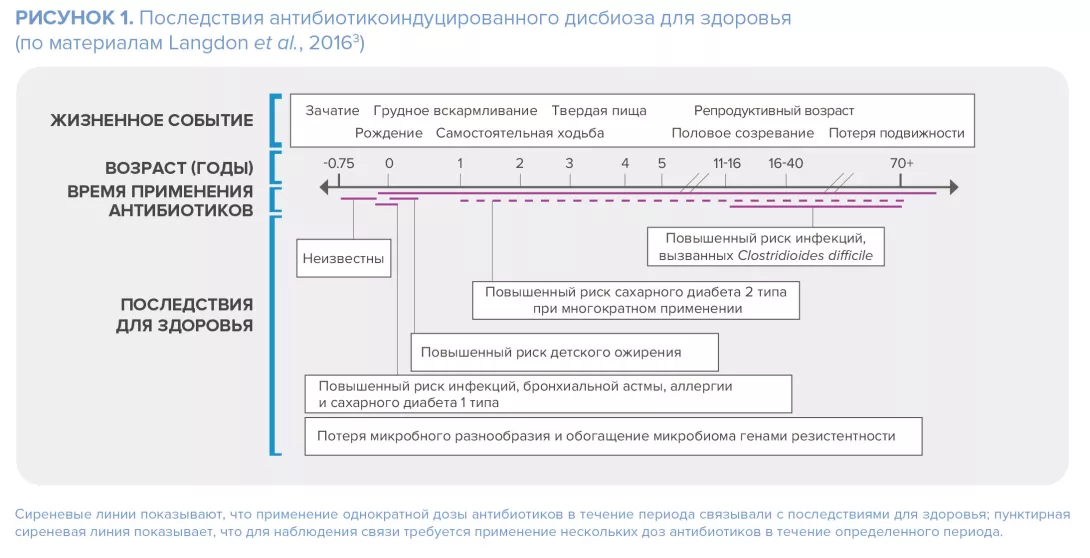
Однако наиболее серьезное беспокойство по поводу использования антибиотиков для лечения акне связано с резистентностью бактерий. Обна- руженная в 1970-х, она является серьезной проблемой в дерматологии с 1980-х годов.8 Резистентность C. acnes наиболее подробно задокументирована: последние данные указывают на то, что частота резистентности в отдельных странах достигает >50% в случае эритромицина, 82–100% в случае азитромицина и 90% в случае клиндамицина. Хотя тетрациклины по-прежнему в значительной степени эффективны против большинства штаммов C. acnes, частота резистентности к ним растет, составляя от 2% до 30% в разных географических регионах9. При этом резистентность к антибиотикам не ограничивается C. acnes: хотя показано, что местные антибиотики, применяемые пациентами с акне (особенно в режиме монотерапии), способствуют появлению резистентных кожных бактерий, таких как S. epidermidis, применение пероральных антибиотиков сопровождалось увеличением числа антибиотикорезистентных S. pyogenes в ротоглотке.10,8 Кроме того, сообщалось, что с лечением акне антибиотиками может быть связана повышенная частота инфекций верхних дыхательных путей и фарингита11,12.
ПРИЗЫВ К ОГРАНИЧЕННОМУ ПРИМЕНЕНИЮ АНТИБИОТИКОВ
Возможные последствия антибиотикорезистентности, вызванной лечением акне, многочисленны: неэффективность самого лечения акне (см. клинический случай), инфекции, вызванные условно-патогенными микроорганизмами (местные или системные) и распространение резистентности в популяции8. Несмотря на это, частота назначения антибиотиков для лечения акне остается высокой, а само лечение проводят дольше, чем рекомендовано в руководствах.13 На фоне этой растущей обеспокоенности эксперты призывают к более осторожному применению антибиотиков в лечении акне.13 В частности, Международный альянс по улучшению результатов лечения акне предложил свою стратегию (см. вставку ниже).
 ВОЗДЕЙСТВИЕ АНТИБИОТИКОВ В ПЕРВЫЕ ШЕСТЬ ЛЕТ ЖИЗНИ РЕБЕНКА НАРУШАЕТ МИКРОБИОТУ КИШЕЧНИКА И ОТРИЦАТЕЛЬНО СКАЗЫВАЕТСЯ НА ЕГО ФИЗИЧЕСКОМ РАЗВИТИИ
ВОЗДЕЙСТВИЕ АНТИБИОТИКОВ В ПЕРВЫЕ ШЕСТЬ ЛЕТ ЖИЗНИ РЕБЕНКА НАРУШАЕТ МИКРОБИОТУ КИШЕЧНИКА И ОТРИЦАТЕЛЬНО СКАЗЫВАЕТСЯ НА ЕГО ФИЗИЧЕСКОМ РАЗВИТИИ
 Новое поколение антибактериальных средств? Плазмида, способная убивать болезнетворные бактерии
Новое поколение антибактериальных средств? Плазмида, способная убивать болезнетворные бактерии