Кишечная микробиота
Почему кишечная микробиота так важна для нашего здоровья?
В нашем кишечнике живут триллионы бактерий, которые выполняют множество удивительных функций.1 Давайте разберемся, как работает наша кишечная микробиота и почему мы должны о ней заботиться.

Что такое микробиота кишечника человека?
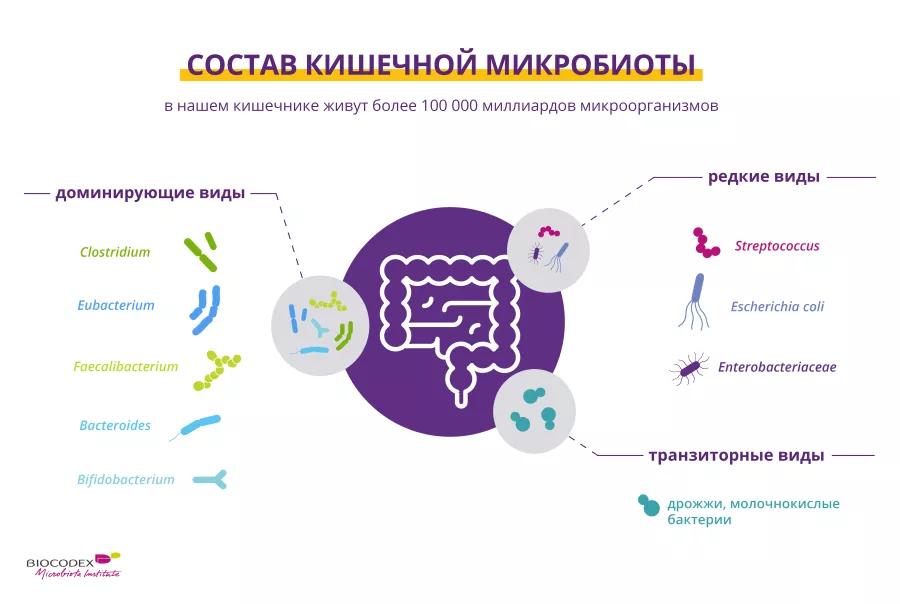
Вы, наверное, уже не раз слышали о «кишечной флоре». По-научному она называется «кишечная микробиота» или «микробиота кишечника». Она состоит1 из триллионов (sidenote: Микроорганизмы очень мелкие живые организмы, неразличимые невооруженным глазом. К ним относятся бактерии, вирусы, грибы, археи и простейшие, обычно называемые «микробами». What is microbiology? Microbiology Society. ) , обитающих в кишечнике, таких как бактерии, вирусы, грибы (в том числе дрожжи) и даже паразиты.
Кстати, слова «микробиота» и «микробиом» часто используют как синонимы, но они имеют разные значения. Термин «микробиота» используется, если речь идет о микроорганизмах и их видах, то есть он отвечает на вопрос «кто там?». А «микробиом» — это геном этих микроорганизмов, то, что содержится внутри них; этот термин отвечает на вопрос2 «что в этих микроорганизмах происходит?», в смысле их функционирования.
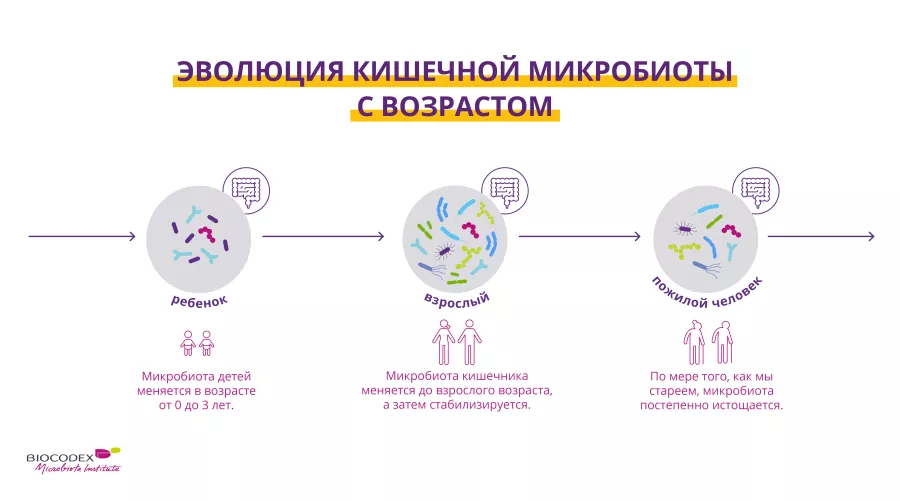
Каждый из нас обладает своей уникальной микробиотой, такой же неповторимой, как, например, отпечатки пальцев.1 Когда мы рождаемся, фекальные и вагинальные микроорганизмы, передающиеся от матери во время вагинальных родов, или микроорганизмы из окружающей среды (в случае кесарева сечения)3 начинают колонизировать кишечник, формируя микробиоту.4
Приблизительно первые три года жизни микробиота кишечника формируется, становится разнообразнее и стабилизируется.5 После достижения взрослого возраста ее состав остается относительно стабильным до наступления старости,6 когда она снова претерпевает глубокие изменения, но уже в худшую сторону.7
Почему микробиота кишечника играет ключевую роль в поддержании нашего здоровья?
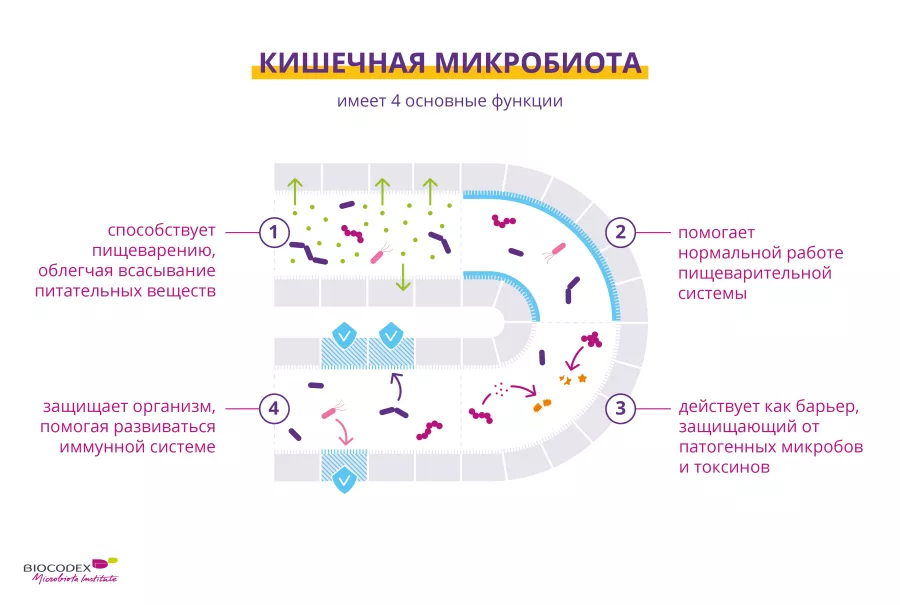
Ряд ученых считает микробиоту кишечника одним из функциональных органов человеческого организма. Этот орган работает в тесной взаимосвязи с кишечником, играя 4 важные роли:
помогая клеткам кишечника всасывать питательные вещества (сахара, аминокислоты, витамины и т. д.), или участвует в ферментативном расщеплении небольшой части пищи. В ходе ферментации образуются различные газы и метаболиты, например короткоцепочечные жирные кислоты, играющие роль «топлива» для бактерий в толстом кишечнике.8
активно участвуя в производстве слизи, ирригации клеток кишечника и модуляции ферментативной активности слизистой оболочки.9
защищающий от патогенных микробов и токсинов.10 Кроме того, некоторые бактерии выделяют антимикробные вещества, угнетающие рост (sidenote: Патоген микроорганизм, который вызывает или может вызвать заболевание Pirofski LA, Casadevall A. Q and A: What is a pathogen? A question that begs the point. BMC Biol. 2012 Jan 31;10:6. ) бактерий, в то время как другие стимулируют выработку слизи, защищающей клетки кишечника от микробной инвазии и развития заболеваний, пагубно влияющих на организм в целом.11
помогая укреплять иммунную систему. Бактерии кишечной флоры способствуют созреванию и активации клеток иммунной системы кишечника, которая защищает нас от болезнетворных бактерий и вирусов. Кишечник — это основной резервуар иммунных клеток в нашем организме. В свою очередь иммунная система влияет на состав и разнообразие микробиоты.12
Какие заболевания связаны с нарушением баланса микробиоты кишечника?
Что такое нарушение баланса (дисбаланс) микробиоты кишечника?
Состав микробиоты кишечника имеет две характеристики: разнообразие (количество видов микроорганизмов, присутствующих в организме человека) и богатство (общее количество присутствующих микроорганизмов). Изменение состава ведет к нарушению равновесия и развитию (sidenote: Дисбиоз Изменение состава и функции микробиоты, вызванное сочетанием экологических и индивидуальных факторов. Дисбиоз не является четко очерченным состоянием и варьируется в зависимости от состояния здоровья каждого человека. Levy M, Kolodziejczyk AA, Thaiss CA, et al. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17(4):219-232. ) ,13 который нередко сопутствует заболеваниям других органов. Дисбиоз — причина или следствие этих заболеваний? На этот вопрос ученые пока не дали однозначного ответа
Рассмотрим несколько заболеваний, связанных с дисбиозом кишечника: диарею, вызванную применением антибиотиков, детскую колику, гастроэнтерит, воспалительные заболевания кишечника (синдром раздраженного кишечника, или СРК):
- Детская колика14 возникает у 20–25% младенцев в возрасте 1–4 месяцев.
- Диарея, вызванная применением антибиотиков, возникает у 5–35% пациентов, получающих антибиотикотерапию.15
- Диарея путешественников представляет собой инфекцию, вызванную зараженной пищей или водой. У 3–17% пациентов с этой инфекцией может возникнуть постинфекционный синдром раздраженного кишечника.16
- Гастроэнтерит, как правило, имеет доброкачественное течение и чаще всего вызывается вирусами. Тем не менее во всем мире он является причиной более 200 000 детских смертей в год.17
- Ожирение — очень распространенное, затратное для общества и системы здравоохранения серьезное хроническое заболевание, которым в 2016 г. страдало 13% взрослых людей во всем мире (11% мужчин и 15% женщин).18
- СРК — одно из самых частых функциональных желудочно-кишечных расстройств, которое проявляется болью в животе и изменением привычного ритма опорожнения кишечника (запором, диареей или их чередованием). Распространенность этого состояния сильно варьируется в зависимости от страны.19
- Болезнь Крона — это воспалительное заболевание кишечника, способное поражать любой отдел пищеварительной системы от рта до ануса. Данные недавних исследований указывают на важную роль кишечной микробиоты в развитии и течении этого заболевания.20
- Рак желудка21 и колоректальный рак22 также связаны с нарушением кишечной микробиоты.
Функции микробиоты кишечника человека не ограничиваются кишечником: недавние исследования показали, что микробиота кишечника может играть определенную роль, выходящую за рамки желудочно-кишечного тракта. Установлено, что микробиота кишечника ассоциируется с развитием ряда внекишечных заболеваний, таких, например, как акне,23 аллергия,2 ожирение,25 тревожные расстройства,26 расстройства аутистического спектра.26 Однако это далеко не все. Есть мнение, что микробиота кишечника может быть связана с развитием таких нейродегенеративных заболеваний, как болезнь Альцгеймера27 и болезнь Паркинсона.28 И действительно, существует двунаправленная связь между кишечником и мозгом, которую называют «ось мозг — кишечник», а микробиота кишечника может влиять на взаимодействия этих органов. Вот почему наш кишечник иногда называют «вторым мозгом».
Как позаботиться о кишечной микробиоте? Ее благополучие — в ваших руках.
Вы уже знаете, насколько важную роль микробиота кишечника играет в поддержании здоровья человека. Но как нам позаботиться о собственной микробиоте? Во многих научных исследованиях поднимался вопрос о том, как избежать нарушений ее состава и сохранить наиболее оптимальный баланс.29 Ответ не так прост, как кажется. Одного только употребления благотворных бактерий или дрожжей с целью обогатить существующую микробиоту или вытеснить болезнетворные микроорганизмы оказывается недостаточно. Главная задача заключается в том, чтобы воздействовать на микробиоту таким образом, чтобы помочь ей функционировать без перебоев и тем самым укрепить собственное здоровье.30
Как? Есть несколько способов положительно повлиять на баланс и разнообразие микробиоты кишечника, и каждый из них имеет свои особенности.
-
Диета: разнообразие и качество нашей пищи способствуют поддержанию баланса микробиоты кишечника.31,32 С другой стороны, несбалансированная диета может негативно повлиять на состав содержимого кишечника и привести к развитию некоторых заболеваний.33 Важно знать, какая пища оказывает благотворное или негативное влияние, чтобы поддерживать кишечник в оптимальной форме.34
-
Пробиотики: это «живые микроорганизмы, которые при употреблении в достаточном количестве приносят пользу здоровью человека».35,36 См. дополнительную информацию о пробиотиках и о том, как они воздействуют на микробиоту, помогая нам оставаться здоровыми.
-
Пребиотики: это особые полезные для здоровья неперевариваемые пищевые волокна, которые избирательно используются полезными микроорганизмами в составе нашей микробиоты37. Некоторые продукты особенно богаты пребиотиками, поэтому важно следить за их наличием в рационе. В некоторых продуктах пребиотики добавляют к пробиотикам — они называются симбиотиками.39
-
Трансплантация: как и «обычные» органы, микробиоту кишечника можно «пересадить» другому человеку с целью восстановить ее нарушенное равновесие32. Трансплантация фекальной микробиоты (ТФМ) — это терапевтическая процедура, одобренная только для лечения рецидивирующей инфекции, вызванной Clostridioides difficile32. Она все еще находится на стадии активного изучения применительно к другим заболеваниям, таким как болезнь Крона, язвенный колит, синдром раздраженного кишечника или метаболические заболевания.32 Дополнительную информацию см. здесь
Да, кое-что еще...
Теперь, когда вы узнали все, что нужно знать о кишечной микробиоте, вам также следует иметь в виду, что микроорганизмы живут и в других частях нашего тела: на коже,40 в мочевыводящих путях,41 влагалище,42 полости рта,43 ушах,44 легких45. Как и в кишечнике, эти микроорганизмы играют огромную роль, помогая этим органам исправно функционировать на благо нашего здоровья.
Вся информация в этой статье получена из официальных научных источников. Следует учитывать, что представленная информация не является исчерпывающей. Ниже приведен перечень исследований, использованных в качестве источников информации
11Sokol H. Microbiota and barrier effect. In: Marteau P, Dore J, eds. Gut Microbiota: A Full-Fledged Organ. Paris: John Libby Eurotext; 2017:65-71.
17 Stuempfig ND, Seroy J. Viral Gastroenteritis. In: StatPearls. Treasure Island (FL): StatPearls
18 WHO. Fact sheets on obesity and overweight June 2021
27 Qian XH, Song XX, Liu XL, et al. Inflammatory pathways in Alzheimer's disease mediated by gut microbiota. Ageing Res Rev. 2021 Mar 9;68:101317.