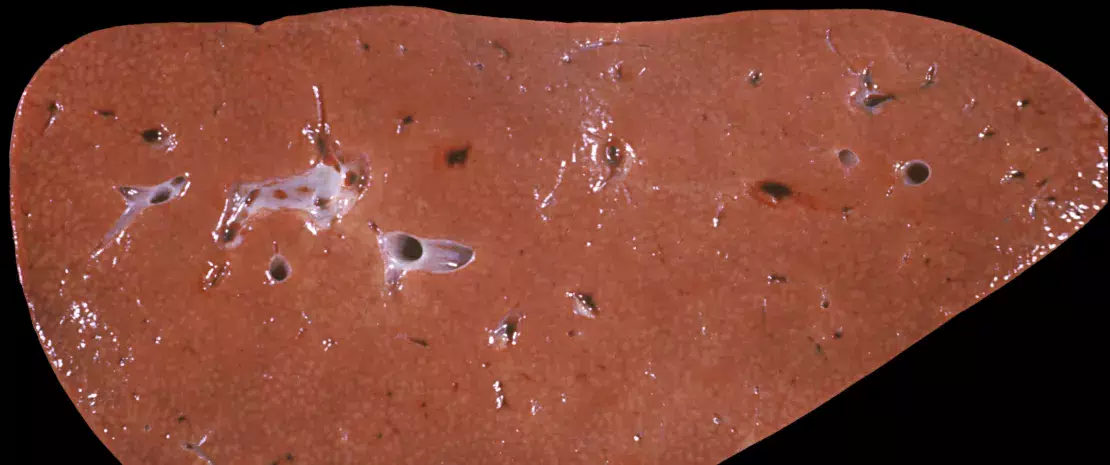
Изменения кишечной микробиоты связывают с тяжестью неалкогольного стеатогепатита (НАСГ). Однако представляющие интерес исследования были ограничены бактериальным дисбиозом, а вирусной микробиоте пациентов уделяли мало внимания. Следовательно, это проспективное перекрестное и обсервационное исследование связей между характеристиками кишечного вирома и различными гистологическими стадиями заболевания является одним из первых. В нем исследователи секвенировали метагеном вирусов стула 73 пациентов с НАСГ на различных стадиях заболевания и 22 участников контрольной группы. Пациенты с высоким индексом активности неалкогольной жировой болезни печени (NAS) и выраженным фиброзом подвержены повышенному риску прогрессирования заболевания, возникновения карциномы и смерти.
Тяжесть связана с вирусным разнообразием
По сравнению с 29 пациентами с НАСГ и низким гистологическим индексом NAS (0-4) или контрольной группой у 44 пациентов с высоким индексом NAS (5-8) или циррозом выявили:
- значительное уменьшение разнообразия кишечных вирусов
- значительное уменьшение доли бактериофагов1 относительно других типов кишечных вирусов, которое было еще более выражено у пациентов, принимавших ИПП (ингибиторы протонной помпы).
Кроме того, тяжесть фиброза возрастала при вирусном дисбиозе.
Причина или следствие?
Таким образом, два маркера тяжести НАСГ (индекс NAS и фиброз) были сопряжены со значимым уменьшением вирусного разнообразия и численности бактериофагов. Однако эти связи были просто корреляционными: для определения того, является ли вирусный дисбиоз причиной или следствием НАСГ, и установления задействованных механизмов требуются дальнейшие исследования. Виром может напрямую влиять на макроорганизм, индуцируя иммунный ответ и/или влияя на бактериальную микробиоту с увеличением количества некоторых фагов лактококков (обычно в наиболее тяжелых случаях) и Bacteroides spp., связанным с уменьшением количества этих бактерий.
Прогностическая модель?
Второй шаг заключался в построении модели, которая включала индекс вирусного разнообразия и простые клинические переменные (возраст, количество тромбоцитов и т. д.), которая бы могла идентифицировать:
- пациентов с тяжелыми формами заболевания с достоверностью 0,95
- фиброз стадии F2-F4 с достоверностью 0,88
Добавление данных о вирусном разнообразии значимо улучшило модели по сравнению с вариантами, основанными исключительно на клинических параметрах или бактериальном разнообразии — двух критериях, на которых другая группа исследователей недавно основывала диагноз цирроза печени и отличала его от фиброза. Таким образом, вместо проведения высокоинвазивной биопсии можно будет идентифицировать пациентов с риском НАСГ (а также терапевтические цели) путем анализа фекальных виромов.
1 Вирус, инфицирующий бактерии