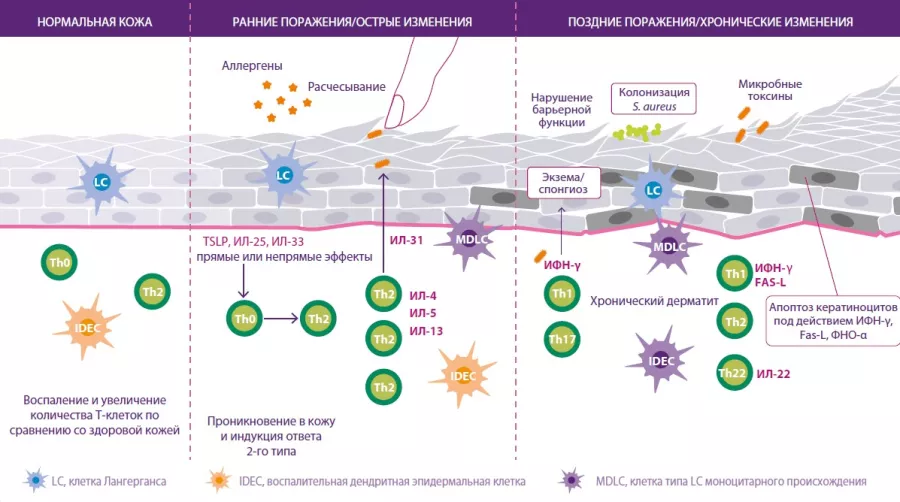
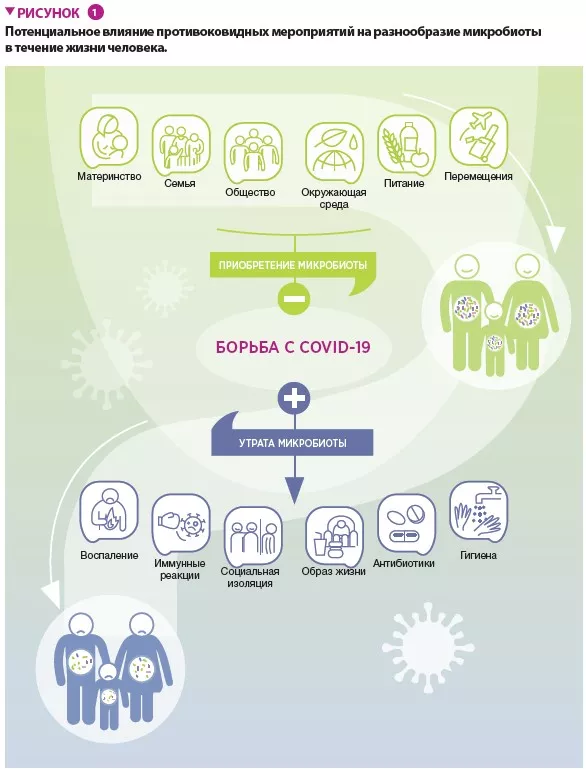
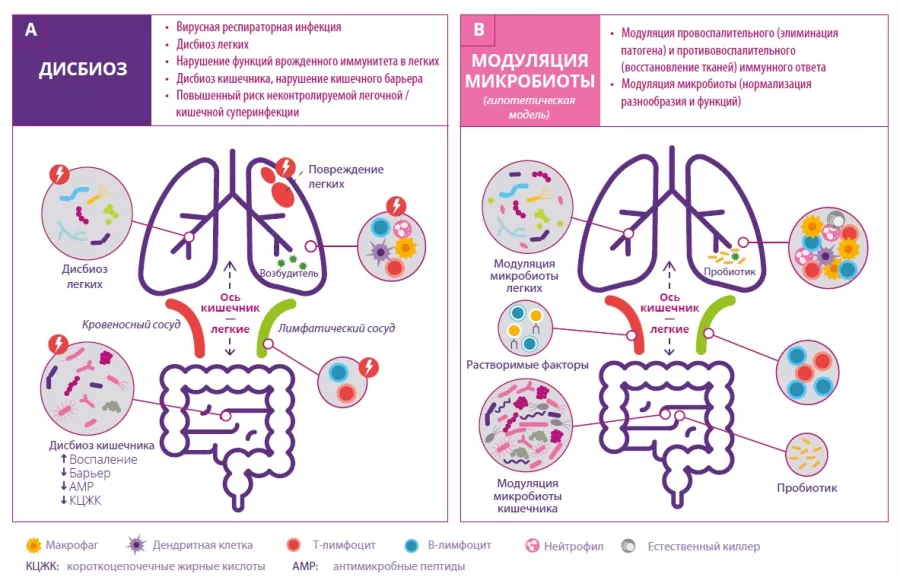
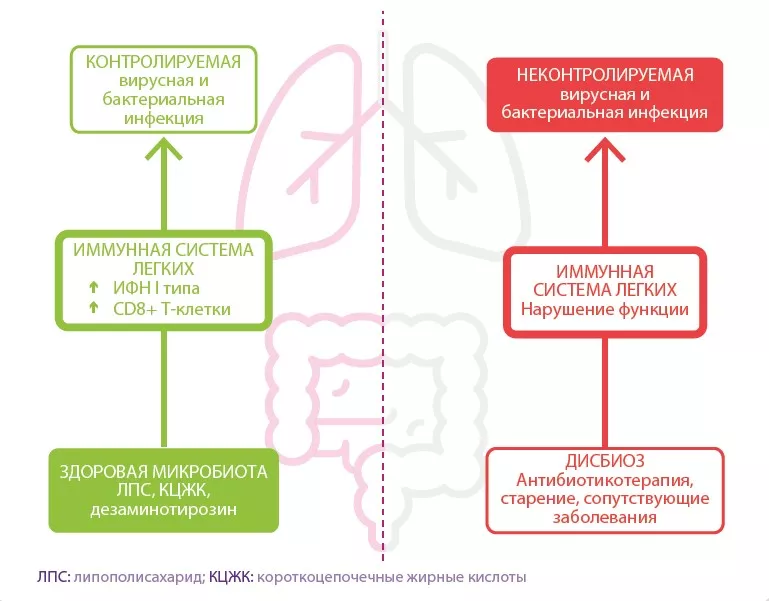
Сперва суставы заклинивают, после чего деформируются — именно так артроз поражает более 3 % населения земного шара, в особенности пожилого возраста. От этого дегенеративного заболевания страдают 10 % мужчин и 18 % женщин старше 60 лет. Его причины могут быть различны: генетические факторы, пол, возраст, ожирение, отсутствие физической активности и, вероятно, микрофлора кишечника. Наряду с другими воспалительными заболеваниями, с которыми уже была установлена связь, кишечная микрофлора также влияет и на возникновение воспалительного процесса, сопутствующего артрозу.
При артрозе наблюдается нарушение микрофлоры кишечника
Чтобы узнать больше о взаимосвязи микрофлоры кишечника и артроза у пожилых женщин, исследователи сравнили бактериальный состав стула 57 женщин в возрасте около 65 лет, страдающих артрозом, и 57 здоровых женщин того же возраста (контрольная группа). В целом микрофлора больных оказалась менее богатой и разнообразной. Некоторые полезные бактерии представлены меньше, например бактерия Bifidobacterium longum, участвующая в регуляции иммунитета, или противовоспалительная бактерия Faecalibacterium prausnitzii, известная своими полезными для человека свойствами. И наоборот, некоторых патогенных бактерий, таких как Clostridium ramosum, оказалось больше обычного. При наличии артроза некоторые функции кишечной микрофлоры, по-видимому, также изменяются, из-за чего больные не могут получить полезные вещества из пищи в полном объеме.
В каких случаях кишечная флора может помочь в диагностике и даже в лечении?
Отличия кишечной микрофлоры пациентов с артрозом и представителей контрольной группы позволяют предположить, что кишечная микрофлора может быть фактором риска для развития заболевания. Команда исследователей попыталась создать инструмент прогнозирования заболевания на основе присутствия 9 бактерий в стуле пациента. Данная модель прогнозирования показала свою эффективность при исследовании пожилых женщин, однако для других групп пациентов подобное исследование не проводилось. Следовательно, наличие таких бактерий может помочь в диагностике. Благодаря изучению этих микроорганизмов могут быть разработаны новые методы лечения артроза на основе пребиотиков или пробиотиков, основной целью которых будет уменьшение болевых ощущений и повышение качества жизни пациентов с артрозом.