Patients stories : vivre avec le Syndrome de l'Intestin Irritable (SII)
PATIENTS STORIES : le Biocodex Microbiota Institute donne la parole aux patients afin qu'ils partagent leur histoire, leur quotidien mais aussi leurs conseils pour apprendre à vivre avec la maladie.
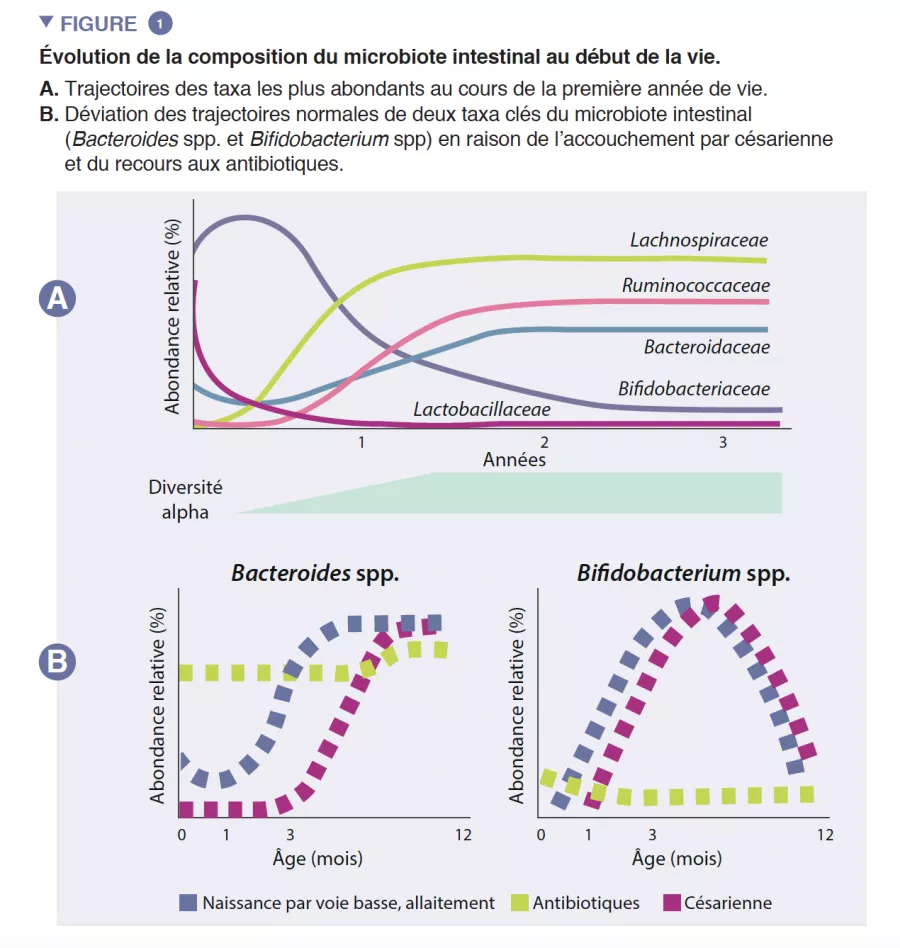
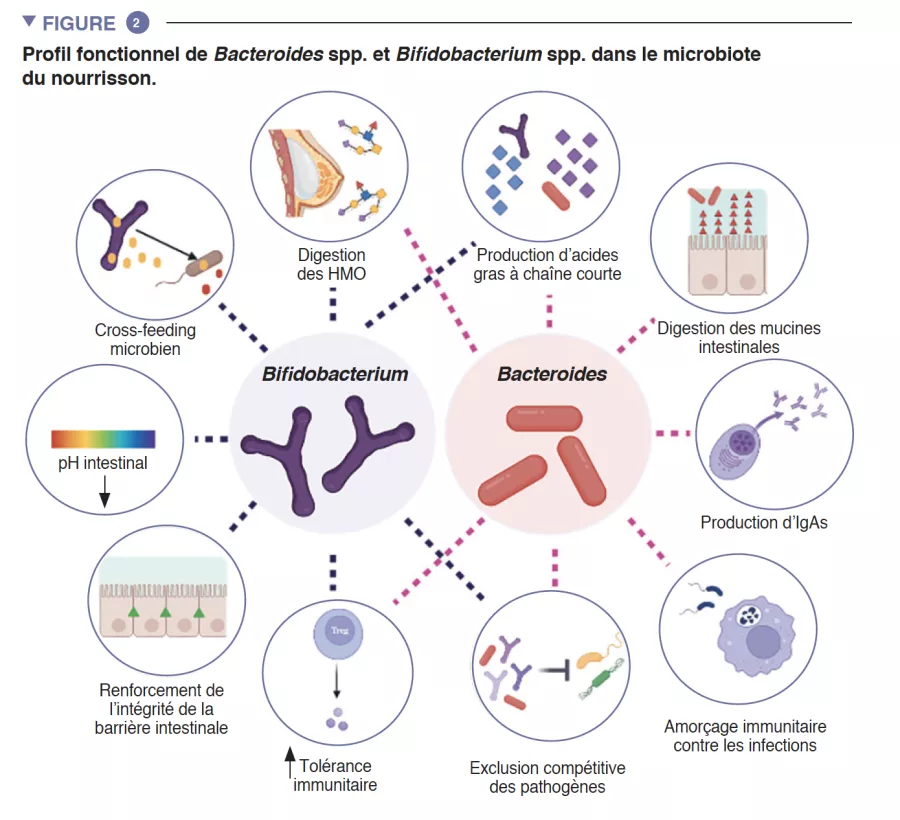
Le microbiote intestinal Le syndrome de l’intestin irritable (SII) TFI Adulte / Enfant
Ce nouveau format est consacré au Syndrome de l'Intestin Irritable (SII) : 75% des personnes atteintes du SII ne seraient pas diagnostiquées alors que cette pathologie toucherait 10% de la population. En cause, le fait que cette maladie ne soit expliquée par aucune anomalie anatomique décelable.
Les premiers épisodes de notre série sont réalisés avec le soutien de l'APSSII.
52% Seule 1 personne sur 2 ayant souffert d’une pathologie digestive impliquant le microbiote fait le lien

Découvrez le témoignage de Jennifer
Âgée de 32 ans, Jennifer est cheffe de produit dans le milieu de la mode. On lui a diagnostiqué un Syndrome de l'Intestin Irritable à l'âge de 29 ans, après 21 ans d'errance médicale.

Je m'appelle Jennifer, j'ai 32 ans et je suis chef de produit dans le milieu de la mode.
Pouvez-vous nous décrire le Syndrome de l'Intestin Irritable ?
Le Syndrome de l'Intestin Irritable, c'est une maladie digestive, chronique, invisible et incomprise.
Quels étaient vos symptômes ?
J'avais de la constipation, comme des poignards dans le ventre, des douleurs, des spasmes, des nausées, des diarrhées de temps en temps et au-delà de ça j'avais aussi une fatigue chronique.
Mes premiers symptômes, étonnamment, étaient des allergies alimentaires et j'ai aussi développé un Syndrome de Raynaud, c'est-à-dire qu'on a les extrémités, les mains et les pieds extrêmement froids, puisque le sang ne circule plus.
J'avais aussi un mal de dos qui m'a obligée à porter une ceinture corset à 25 ans.
Combien de temps a-t-il fallu attendre avant le diagnostic ?
J'ai ressenti ces symptômes pendant 21 ans avant d'avoir le diagnostic à 29 ans.
Quel événement vous a poussé à consulter un médecin ?
Un matin, je me lève encore extrêmement fatiguée, très en retard pour aller au travail. Et là, je m'écroule.
Où avez-vous cherché conseil à propos de vos symptômes ?
Au départ, j'ai cherché conseil auprès de mes médecins généralistes, des gastro-entérologues mais les réponses étaient toujours les mêmes : comme j'étais d'origine plutôt constipée, on me donnait beaucoup de laxatifs et on ne cherchait pas plus loin. J'ai cherché aussi auprès de rhumatologues et je n'ai jamais eu de réponse jusqu'au dernier gastro-entérologue qui m'a vue, et qui m'a parlé du Syndrome et des FODMAP.
Les FODMAP c’est quoi ?
C'est les sucres fermentescibles dans les aliments et cela peut poser problème aux personnes qui sont atteintes du Syndrome de l'intestin irritable.
Saviez-vous que votre microbiote intestinal pouvait jouer un rôle dans le SII ?
Je savais que mon microbiote était impliqué à partir du moment où le gastro-entérologue m'a fait prendre conscience que c'était mon alimentation qui posait problème. A partir du moment où j'ai changé mon alimentation, où j'ai mis en place un protocole FODMAP et où j'ai réussi à reprendre soin de mon microbiote, tous mes symptômes ont disparu. Mais vraiment tous.
Vivre avec le SII au quotidien ça ressemble à quoi ?
Au quotidien, je gère la maladie avec une bonne hygiène de vie. Il faut vraiment que je dorme et il faut que je fasse attention à ce que je mange. Et j'essaye aussi d'éviter du mieux que je peux toute source de stress inutile qui pourrait aussi agir sur mon ventre et du coup sur ma tête.
Que pouvez-vous nous dire du lien intestin-cerveau dans le SII ?
Pour moi, l'Intestin Irritable, c'est le fait que la tête et le ventre soient complètement liés. Pour moi, c'est même l'intestin le premier cerveau. Quand ça va mal au niveau du ventre, ça ne peut qu'aller mal dans la tête.
Votre message pour les personnes atteintes du SII ?
Comme conseil que je pourrais donner aux personnes atteintes d'Intestin Irritable, j'en ai plein et j'en ai d'ailleurs fait un blog qui s'appelle foodmapers.com dans lequel je rassemble tous mes conseils.
Écoutez-vous, faites-vous confiance. Ce n'est pas dans votre tête. S'il y a quelque chose que vous sentez qui ne va pas c'est peut-être en lien avec votre microbiote et la façon dont vous digérez.
Je l'ai vécu. On ne peut pas continuer inlassablement de faire des radios, des échographies pendant 20 ans et toujours se faire entendre dire il n'y a rien. C'est sûr qu'il peut y avoir quelque chose. Et une fois qu'on a ce diagnostic là, il y a plein de choses à faire sur le plan nutritionnel, sur le plan de l'anxiété, sur le stress, sur le sommeil.
Le mot de la fin
Il faut rester positif, mais surtout continuer d'investiguer, ne pas baisser les bras et trouver les professionnels de santé qui seront à même à vous épauler et de vous aider à trouver ce qui ne va pas.
-
Son blog FOODMAPERS
-
Son podcast LES DIGÉRABLES

Découvrez le témoignage de Mihai
Après une appendicite aiguë, Mihai, 25 ans, a développé un syndrome de l'intestin irritable. Il nous raconte comment son quotidien a été bouleversé depuis le diagnostic et évoque les contraintes auxquelles il est désormais confronté.

Bonjour, je m'appelle Mihai,j'ai 25 ans. Je suis secrétaire en maison de retraite et je suis atteint du Syndrome de l'Intestin Irritable.
Pouvez-vous décrire le syndrome du côlon irritable ?
C'est une maladie au niveau du système digestif qui n'est pas maligne mais bénigne.
Quels étaient vos symptômes ?
Des maux de ventre, des ballonnements, des gonflements. Je ne pouvais plus manger ce que j'aimais, ni boire. Le ventre gargouille, vibre. On dirait que j'ai un téléphone
dans la poche et j'ai perdu 35 kilos en six sept mois.
Qu'est-ce qui vous a poussé à consulter un médecin ?
J'ai développé le SII suite à ma période d'appendicite aiguë. J'ai contracté du coup des maux de ventre. J'ai fait pas mal d'examens,
un passage aux urgences. Ils m'ont donné des traitements, et cetera mais qui n'ont pas fait effet.
Combien de temps a-t-il fallu attendre avant le diagnostic ?
Sur cette période 2016-2022, J'ai vu six gastro-entérologues et par la suite je suis retourné
aux urgences et un interne m'a dit “Bon, je sais ce que vous avez, vous avez l'intestin irritable”.
Où avez-vous cherché des conseils concernant vos symptômes ?
J'ai cherché des informations au niveau des associations, l’APSSII où je suis actuellement adhérent et par ailleurs Instagram et d'autres réseaux sociaux.
Le rôle du microbiote ?
Je savais que le microbiote était impliqué dû à des vidéos sur le microbiote intestinal et par la suite des associations d'où l’APSSII. J'ai fait des réunions en visio avec certaines personnes qui ont ce même problème et ils m'ont parlé de la flore intestinale microbienne.
Qu'est-ce que ça fait de vivre avec le SII au quotidien ?
C'est une maladie qui est difficile à vivre au quotidien. Je ne peux plus prendre
les transports en commun. Je suis obligé d'annuler mes soirées
avec mes amis parce que ça m'empêche de vivre. Il y a des jours où j'ai envie de faire des choses, mais je ne peux pas parce que
le ventre dit le contraire. Malgré le fait que je travaille, que j'essaye d'avoir une vie convenable pour moi et c'est compliqué.
Votre message pour les personnes atteintes du SII ?
C’est déjà consulter, s'alimenter au mieux par rapport à ce qu'on a. J'ai appris à vivre avec le stress. Je suis relax maintenant, mais
il faut simplement écouter son corps et ce qu'on ressent aussi, c'est la moindre des choses, écouter son corps avant tout.

Découvrez le témoignage d'Aline
Aline, 50 ans, souffre du Syndrome de l’Intestin Irritable depuis son enfance. Malgré les difficultés au quotidien, elle a aujourd’hui appris à vivre avec la maladie pour mener l’existence la plus normale possible.

Je suis Aline, j'ai 50 ans, dans la vie professionnelle, je suis chargée de mission environnement et je souffre effectivement du Syndrome de l'Intestin Irritable.
Pouvez-vous nous décrire le Syndrome de l'Intestin Irritable ?
Le SII c'est un ensemble de symptômes qui atteignent l'intestin et en particulier le côlon, qui vont créer douleurs, ballonnements, constipation ou diarrhée selon les patients ou alternance des deux et surtout une hypersensibilité viscérale, chez moi, en particulier.
Qu'est ce qui déclenche vos crises ?
Tout stress, toute angoisse, tout mal-être psychologique se traduit souvent par des coliques, des crampes ou des douleurs pour lesquels il faut s'adapter, apprendre à vivre avec au mieux.
Une anecdote à nous partager ?
Anecdote insolite, la caissière me regarde avec un certain aplomb, sûre d’elle, et elle dit “Eh bien, messieurs dames, veuillez laisser passer la dame enceinte”. La dame enceinte, c'était moi.
Comment s'est déroulé votre diagnostic ?
Le médecin tâtonnait sur l'appellation, sur le traitement aussi. Toute l’enfance, toute l’adolescence, les médecins parlaient plutôt de fragilité intestinale, de colopathie colite spasmodique. Mais l'expression Syndrome de l'Intestin Irritable est venue vraiment très tardivement. Je devais avoir une trentaine d'années de mémoire.
Où avez-vous cherché conseil à propos de vos symptômes ?
J'ai appris pas mal de choses par moi-même, via l’APSSII, via des conférences organisées par l’APSSII, les journées annuelles. Au fait, j'ai besoin de comprendre, même si tout ne s'explique pas, mais j'ai vraiment besoin de le comprendre, d'être actrice par rapport à la pathologie.
Et le microbiote dans tout ça?
Le microbiote, c'est tout un ensemble de 10 000 milliards de bactéries et de champignons, d'archées qui jouent de multiples rôles au service de l'intestin, mais aussi de l'organisme dans son ensemble puisqu'il contribue à la digestion. Digestion des fibres, en particulier, à la production de certaines vitamines, à la formation du système immunitaire. Intestin et cerveau communiquent via le nerf vague. chez moi c’est une autoroute parce que je pense que les informations vont très très vite. Donc c'est vraiment un acteur majeur de la santé intestinale et de la santé de l'homme en général.
Vivre avec le SII au quotidien, ça ressemble à quoi ?
Au quotidien, comment gérer ? Alors je ne vous cache pas que ce n'est pas toujours facile. J'essaye de mener la vie la plus normale possible. Je ne veux pas que ça me cantonne à une vie restreinte, seule chez moi, surtout pas, ce serait pire.
Votre message pour les personnes atteintes du SII ?
En conclusion, pour les patients qui souffrent du SII, c’est surtout, ne restez pas isolés, parlez-en, faites-vous aider par les médecins et médecins spécialistes et menez la vie la plus normale possible avec le moins d'interdits possible surtout.
Vous souhaitez contacter une association de patients ?
Découvrez l'APSSII :
L'Association des Patients Souffrant du Syndrome de l'Intestin Irritable
L'association peut être contactée par mail à secretariat@apssii.org
ou par téléphone au 07 83 25 82 60
Association reconnue d’intérêt général et agréée par le Ministère en charge de la Santé.
Qu'est-ce que le Syndrome de l'Intestin Irritable ?
Attention
Biocodex Microbiota Institute est dédié à l'éducation sur le microbiote humain pour le grand public et les professionnels de la santé, il ne donne aucun conseil médical.
Nous vous recommandons de consulter un professionnel de santé pour répondre à vos questions et demandes.
BMI 23.03
 Comment notre intestin dialogue en permanence avec notre cerveau
Comment notre intestin dialogue en permanence avec notre cerveau
 Le microbiote intestinal : un monde encore largement inexploré
Le microbiote intestinal : un monde encore largement inexploré