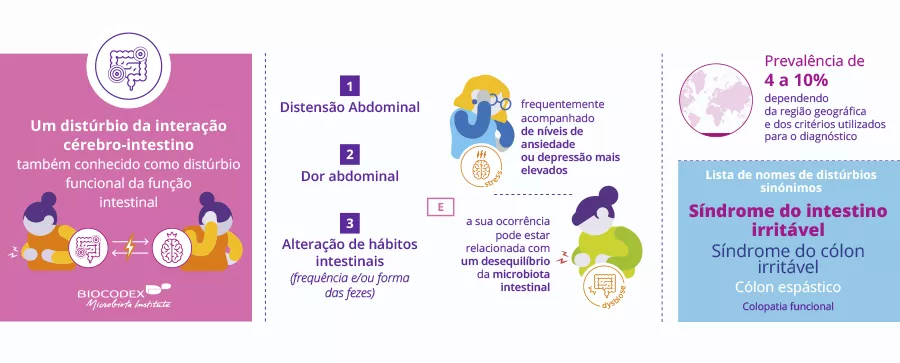
O QUE É QUE JÁ SABEMOS SOBRE ISTO?
As perturbações do desenvolvimento neurológico são frequentes em crianças pequenas, afetando até 8,4% dos indivíduos com menos de 5 anos de idade em todo o mundo. O crescimento da circunferência da cabeça (HCG) é um marcador correlacionado com o neurodesenvolvimento precoce.
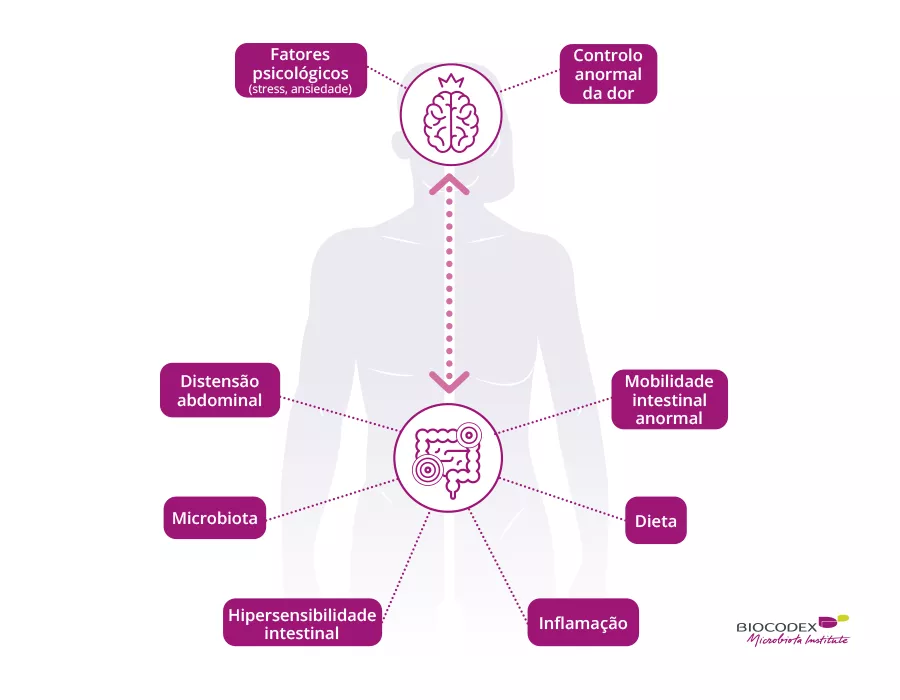
É importante procurar fatores ambientais que possam ser modificados para reduzir as perturbações do desenvolvimento neurológico. Os estudos de nutrição interventiva não demonstraram resultados significativos no neurodesenvolvimento (por exemplo: o benefício do aleitamento materno). Os autores investigaram o microbioma intestinal (GM) porque a sua aquisição durante os primeiros meses de vida e o uso de antibióticos durante o primeiro ano estão associados a várias patologias, incluindo as perturbações do neurodesenvolvimento mais tarde na infância, em particular a perturbação do défice de atenção e a perturbação do espectro do autismo. O objetivo do estudo era determinar se existe uma relação entre as características do GM inicial e uma trajetória subótima do HCG (SHCGT).
QUAIS SÃO AS PRINCIPAIS CONCLUSÕES DESTE ESTUDO?
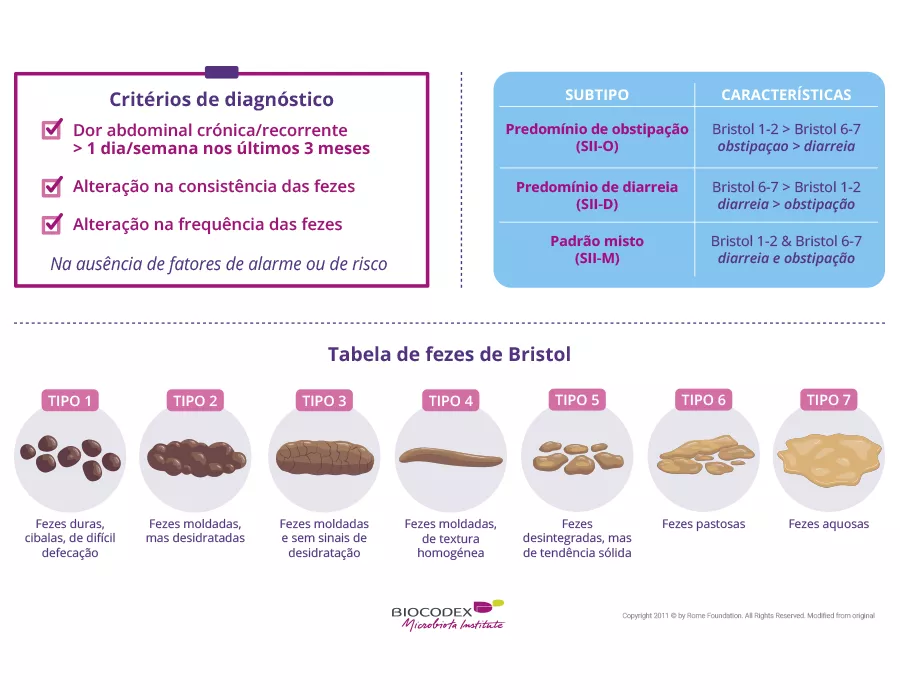
Os bebés com < 37 semanas de idade pós-menstrual (unidade de cuidados neonatais de Chicago) foram incluídos entre janeiro de 2010 e dezembro de 2018. A trajetória do HCG foi a diferença entre os z-scores da circunferência da cabeça medidos à nascença e às 36 semanas pós-menstrual (PMA); foram utilizadas perdas de 0,5 z-scores de intervalo para definir os grupos com uma trajetória adequada de HCG (AHCGT) ou uma trajetória subótima (ligeiramente, moderada e severamente prejudicada, SHCGT).
A β-diversidade do GM diferiu significativamente entre os bebés SHCGT e AHCGT, assim como a alteração da abundância dos taxa nas amostras de fezes a 30 PMA. A perda em HCG z- score > 0,5 ocorreu entre 31 e 36 semanas PMA nos grupos SHCGT. Isto sugere que um GM “imaturo” precede o SHCGT.
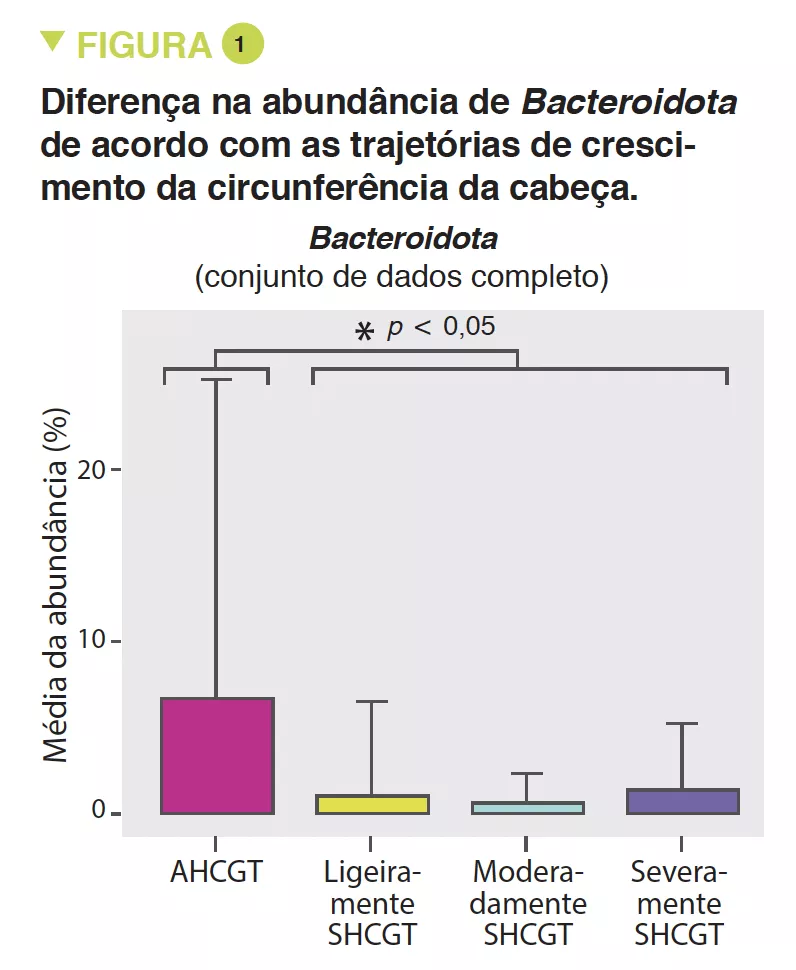
SHCGT infants had a significantly decreased abundance of Bacteroidota (p = 0.0009) (Figure 1) and Lachnospiraceae (p = 0.009), between 31 and 36 weeks PMA, which may result in a reduced carbohydrate utilisation capacity of these taxa. The prevalence of the Ruminococcaceae family (p = 0.007) was attributed to the species Faecalibacterium prausnitzii (p = 0.004), 48% in the AHCGT vs 8% in the SHCGT infants. It is to be noted that there was an increase in Firmicutes in the SHCGT groups from 24 to 30 weeks PMA (p = 0.009) but without any difference in the sub-taxa.
Os bebés SHCGT tiveram uma diminuição significativa da abundância de Bacteroidota (p = 0,0009) (Figura 1) e Lachnospiraceae (p = 0,009), entre 31 e 36 semanas de PMA, o que pode resultar numa redução da capacidade de utilização de hidratos de carbono destes taxa. A prevalência da família Ruminococcaceae (p = 0,007) foi atribuída à espécie Faecalibacterium prausnitzii (p = 0,004), 48% no AHCGT vs 8% nos bebés SHCGT. É de notar que houve um aumento de Firmicutes nos grupos SHCGT de 24 para 30 semanas PMA (p = 0,009) mas sem qualquer diferença na sub-taxa.
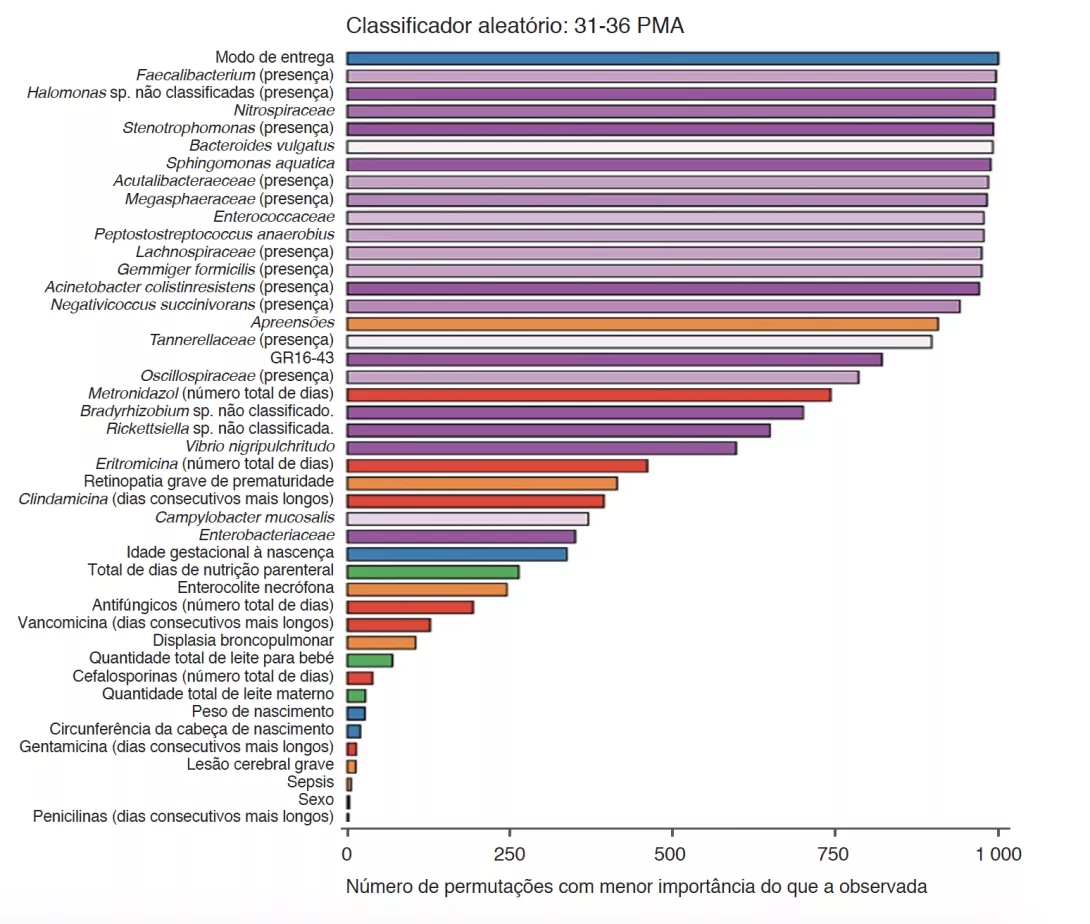
A análise dos parâmetros clínicos mostrou que as alterações no HCG não se deviam a restrições calóricas. Houve mais morbilidades nas crianças dos grupos SHCGT do que naquelas com AHCGT: enterocolite necrosante (p = 0,0006), lesão neurológica grave (p = 0,01), sepsis (p = 0,03). Contudo, os métodos analíticos utilizados, tais como a decisão aleatória com permutações, mostraram que os fatores mais importantes associados às trajetórias do HCG foram as características do GM e não as comorbilidades, quer de 24 a 30 PMA ou de 31 a 36 PMA (Figura 2). Em bebés livres de morbilidades graves, as diferenças em Bacteroidota e Lachnospiraceae ainda estavam presentes, mas a abundância de Actinobacteriota foi significativamente maior no grupo AHCGT e no grupo SHCGT ligeiro do que nos grupos moderada e severamente SHCGT. O tipo de parto teve mais efeito nas trajetórias de HCG do que fatores que influenciam o GM, tais como nutrição entérica e tratamentos com antibióticos. Isto está ligado à transmissão do GM no parto porque a abundância de Bacteroidota foi maior em bebés por parto vaginal do que naqueles com parto por cesariana. Além disso, entre os bebés por parto vaginal, aqueles com um SHCGT tiveram uma queda na abundância dos taxa acima descritos como relacionados com as trajetórias do HCG, em comparação com o AHCGT. Além disso, o termo de nascimento é um fator importante porque todos os bebés SHCGT por parto vaginal nasceram < 27 semanas de idade pós-menstrual, enquanto apenas 17% dos bebés AHCGT por parto vaginal nasceram < 27 semanas de idade pós menstrual.
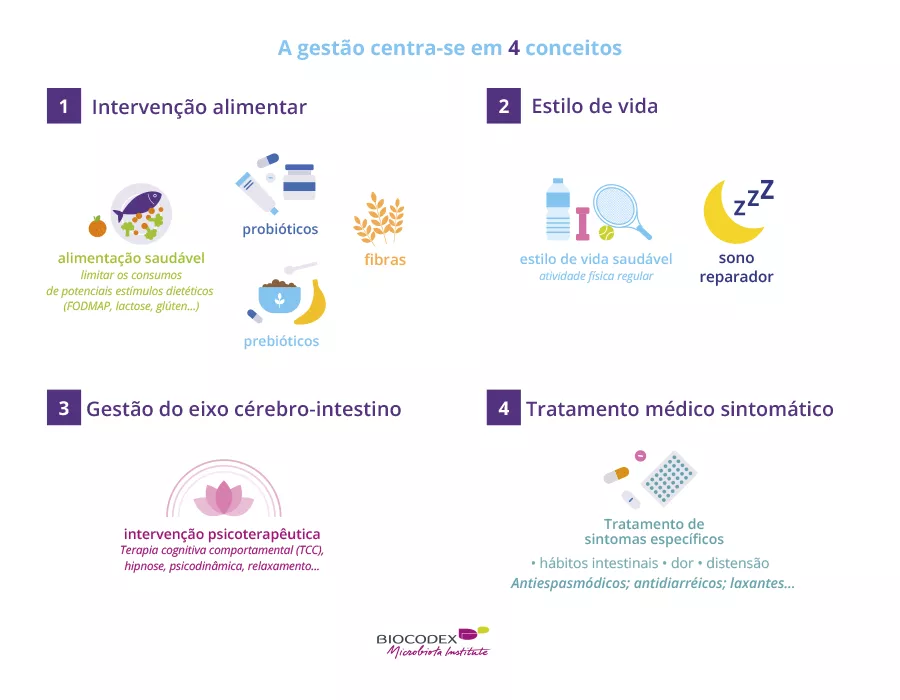
QUAIS SÃO AS CONSEQUÊNCIAS PRÁTICAS?
Sugere-se, portanto, que SHCGT começa com uma redução da abundância de Bacteroidota e Lachnospiraceae, e depois é exacerbado com a redução em Actinobacteriota.
O nascimento por via vaginal permite a transmissão vertical de Bacteroidota.
Deve-se, no entanto, estar vigilante em relação aos bebés nascidos antes das 27 semanas de PMA, porque mesmo aqueles que nascem por via vaginal parecem estar em maior risco de SHCGT.

 Uma dieta mediterrânica boa para o corpo e boa para o coração
Uma dieta mediterrânica boa para o corpo e boa para o coração