Doença inflamatória da pele, a dermatite atópica (DA) é uma afeção complexa e multifatorial, possuindo caraterísticas genéticas (anomalias que afetam a codificação genética da filagrina, que participa na barreira cutânea), imunitárias e também microbianas. Por exemplo, a pele dos pacientes com DA apresenta normalmente uma maior abundância de Staphylococcus aureus. Mas, e quanto às comunidades de fungos? Um estudo recente1 acaba de lançar luz sobre esta área cinzenta.
Menos Malassezia em caso de dermatite atópica grave
Foram colhidos esfregaços de pele de 16 pacientes com DA (9 com DA ligeira a moderada e 7 com DA grave) e 16 indivíduos saudáveis, em 4 locais da pele (prega antecubital, pescoço dorsal, glabela e vértice). Para se acompanhar a evolução da doença por crise, foram recolhidas amostras em 3 datas (semanas 0, 2 e 4) no caso dos doentes e em 2 datas nos controlos (semanas 0 e 4).
A análise dos 320 esfregaços revelou que o fungo Malassezia (especialmente as espécies M. restricta e M. globosa) predominava em todos os indivíduos, tanto saudáveis como doentes. No entanto, nos pacientes com DA grave, esta dominância esvai-se a favor de fungos como Candida ou Debaryomyces, resultando numa maior diversidade fúngica.
Quanto às bactérias, Cutibacterium surgem em baixa, enquanto os Staphylococcus, e em particular S. aureus e S. epidermidis, reforçam a sua presença. A maior abundância de S. aureus poderá favorecer a proliferação de Candida, numa atividade sinérgica entre os dois microrganismos que já foi anteriormente demonstrada.
Finalmente, durante as 4 semanas de observação, as microbiotas fúngica e bacteriana não se alteraram, independentemente do local da pele.
Em relação com a gravidade da DA
O estudo mostra também uma ligação entre a disbiose cutânea e o grau da DA: as comunidades bacterianas e fúngicas dos pacientes com DA grave diferiram significativamente das dos pacientes com sintomas ligeiros a moderados e das dos controlos. As comunidades cutâneas destes dois últimos grupos (formas ligeiras a moderadas e controlos) surgiram globalmente semelhantes, com algumas exceções bacterianas (mais estafilococos e menos Cutibacterium na DA ligeira a moderada contra nenhuns na ausência de DA). Assim, uma disbiose pronunciada da microbiota é característica das formas graves, mas não das formas menos pronunciadas de dermatite.

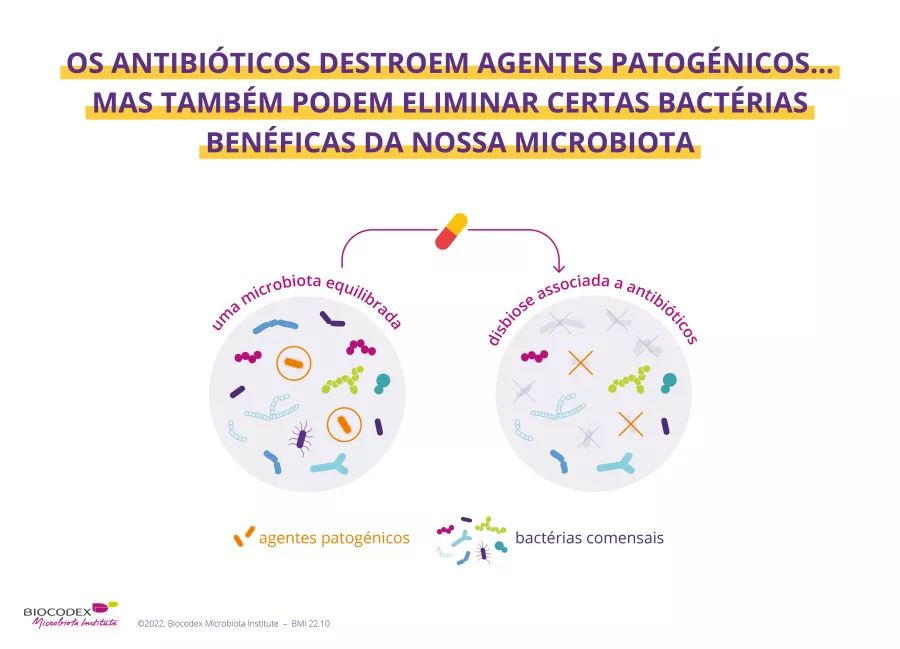
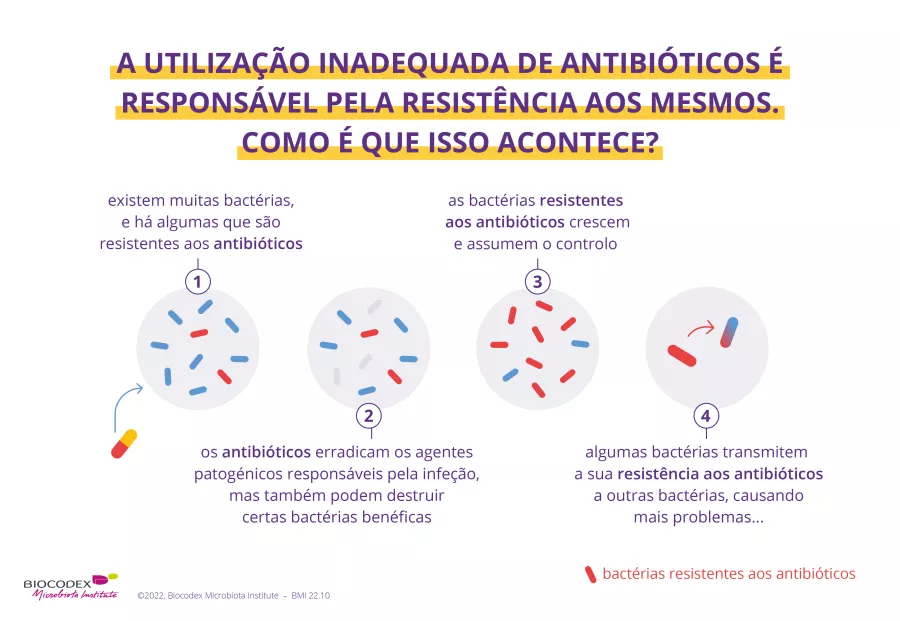
 Resistência aos antibióticos: uma ameaça mundial, uma resposta global
Resistência aos antibióticos: uma ameaça mundial, uma resposta global
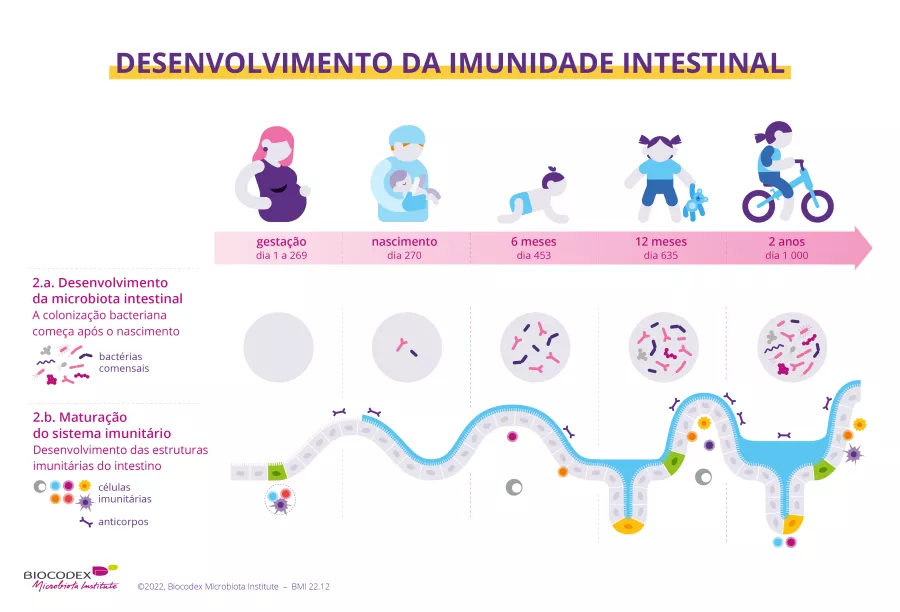
 Compreendermos a interação complexa Entre a microbiota e a imunidade e algo que esta apenas a dar os primeiros passos
Compreendermos a interação complexa Entre a microbiota e a imunidade e algo que esta apenas a dar os primeiros passos