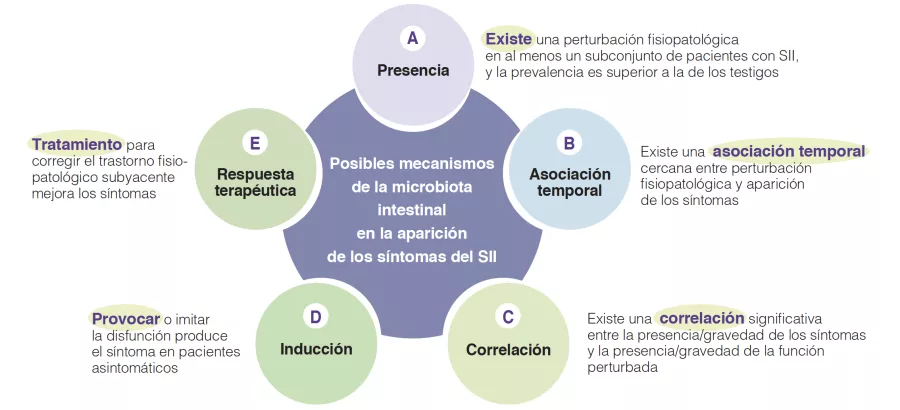
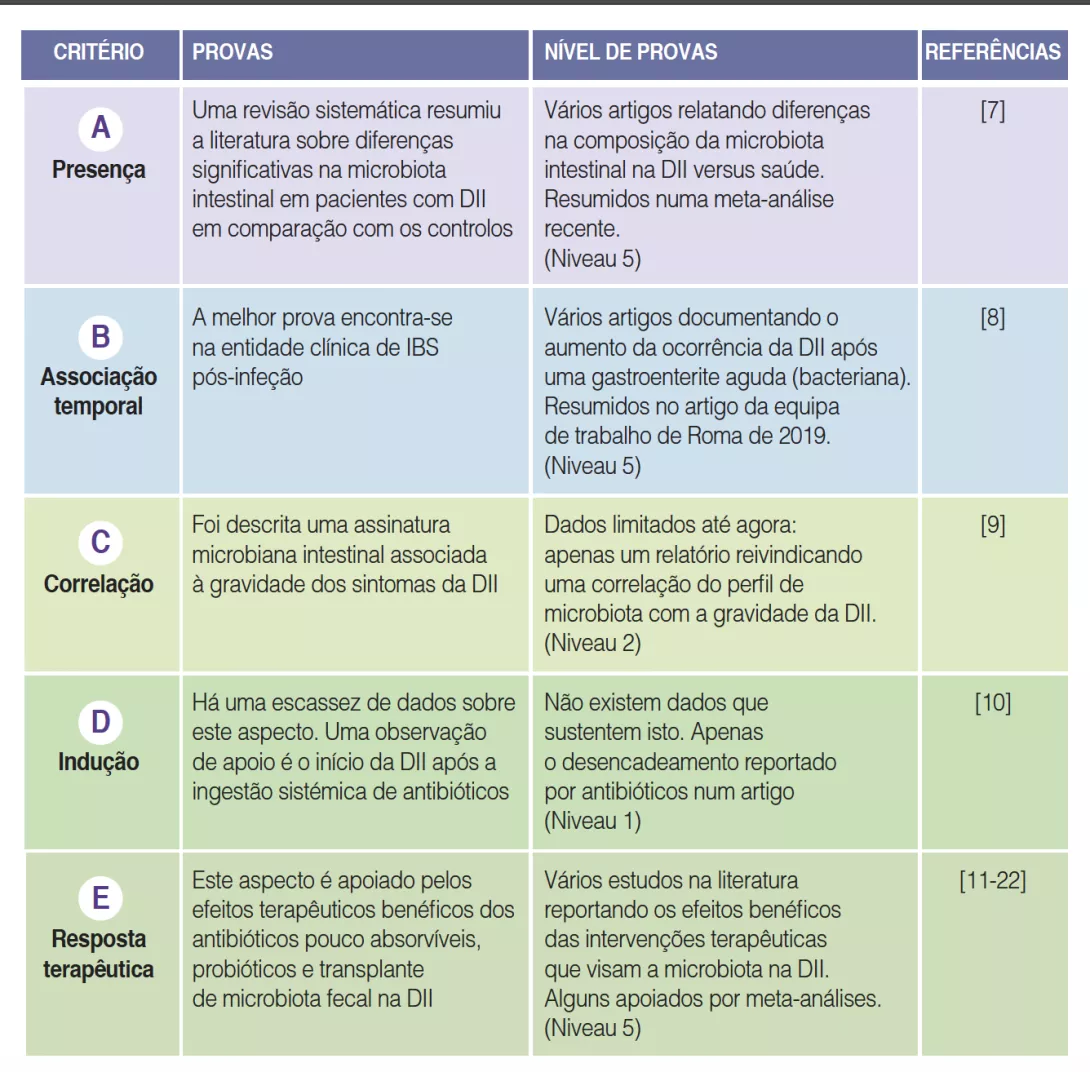
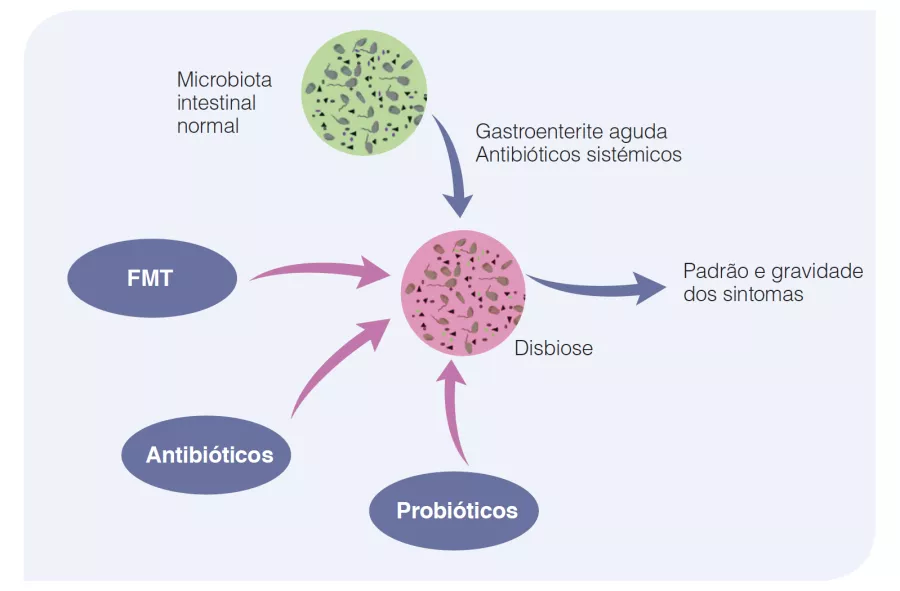
O que é que já sabemos sobre isto?
O número de crianças com uma alergia alimentar está a aumentar muito, representando atualmente 28% das crianças americanas com idades entre 1 e 5 anos. O estabelecimento da microbiota intestinal (MI) nos primeiros meses de vida pode estar envolvido nesta sensibilização aos alergénios alimentares [2]. Muitos fatores influenciam o estabelecimento da MI, como o tipo de parto (cesariana vs. vaginal), o tipo de amamentação (aleitamento materno ou de fórmula) e a utilização de antibióticos [3, 4]. Um estudo recente mostrou que a estrutura da MI também variava significativamente entre diferentes grupos étnicos [5].
Além disso, a transferência de MI de crianças saudáveis para ratos protege-os da alergia às proteínas do leite de vaca. Uma MI fraca nos lactentes pequenos e um nível alto de Enterobacteriaceae/Bacteroidaceae (E/B) nos lactentes pequenos e mais velhos são fatores preditivos de sensibilização aos alergénios alimentares [6].
Quais são as principais conclusões deste estudo?
O estudo incluiu 1 422 crianças da coorte canadiana CHILD (Canadian Healthy Infant Longitudinal Development) e foram realizados testes de picada (pneumoalérgenos e alérgenos alimentares) à idade de 1 e 3 anos. Foram colhidas amostras de fezes precocemente (3,5 ± 0,9 meses) e tardiamente (12,2 ± 0,3 meses).
A prevalência de atopia foi de 12% ao 1 ano e 12,8% aos 3 anos, com 9,5 e 5,8% de sensibilização alimentar e 3,3 e 10,1% de sensibilização aos pneumoalérgenos ao 1 e aos 3 anos, respetivamente.
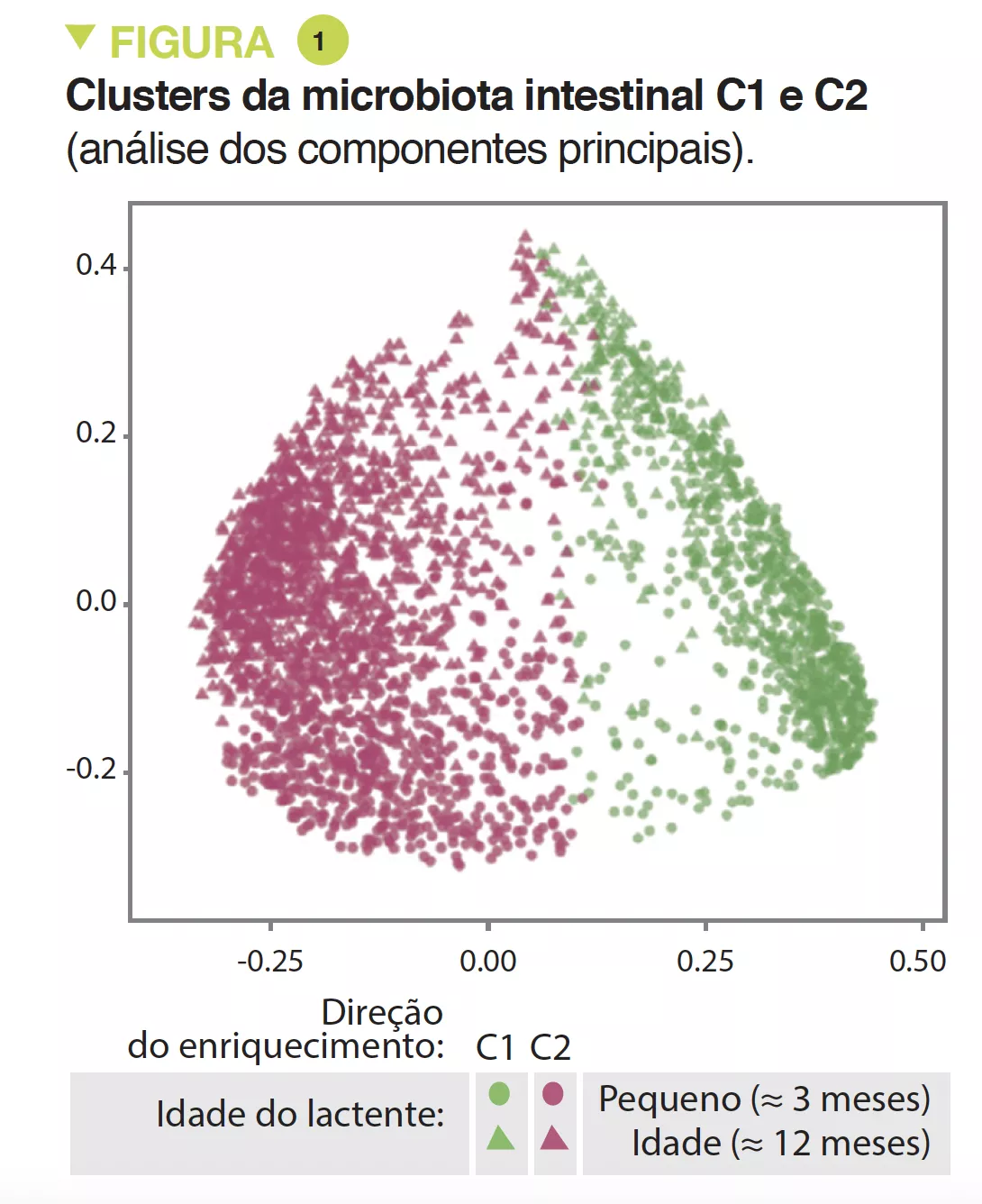
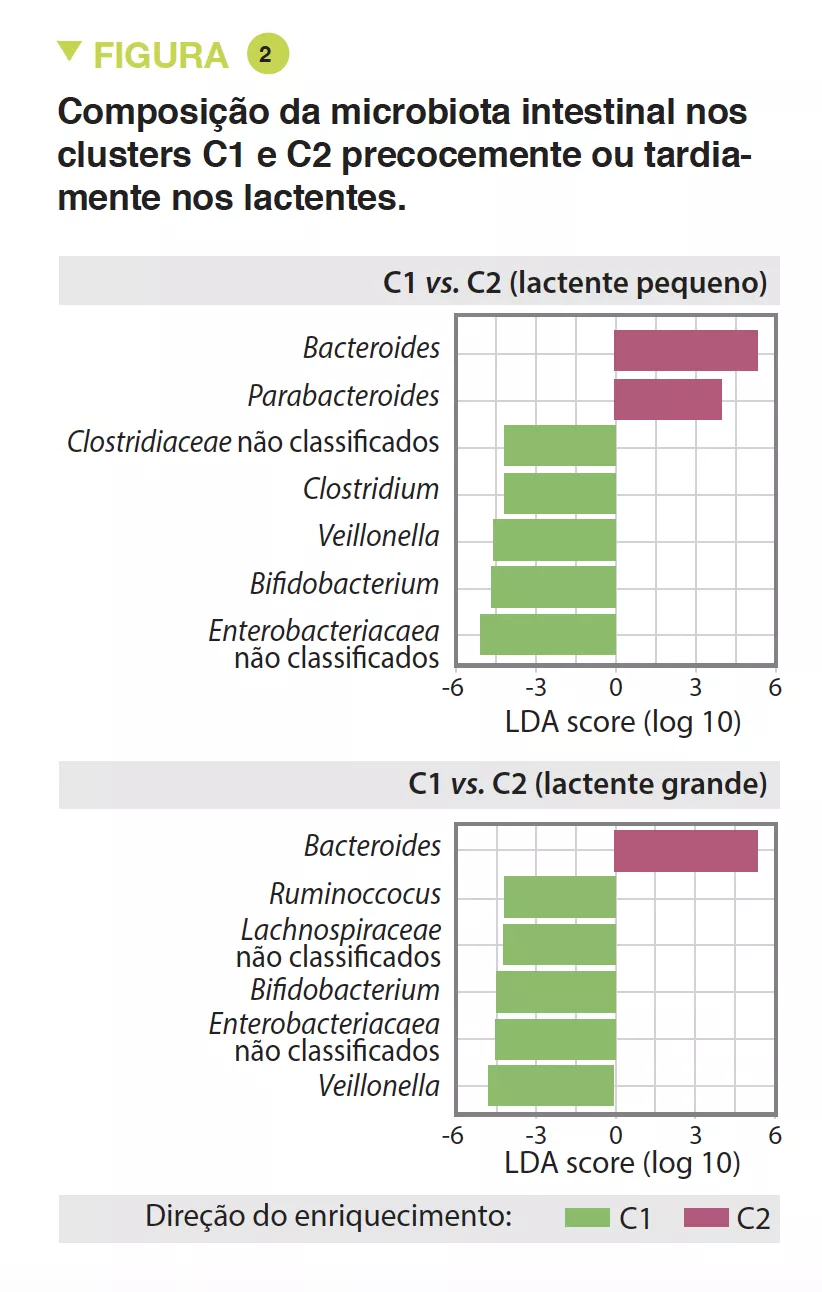
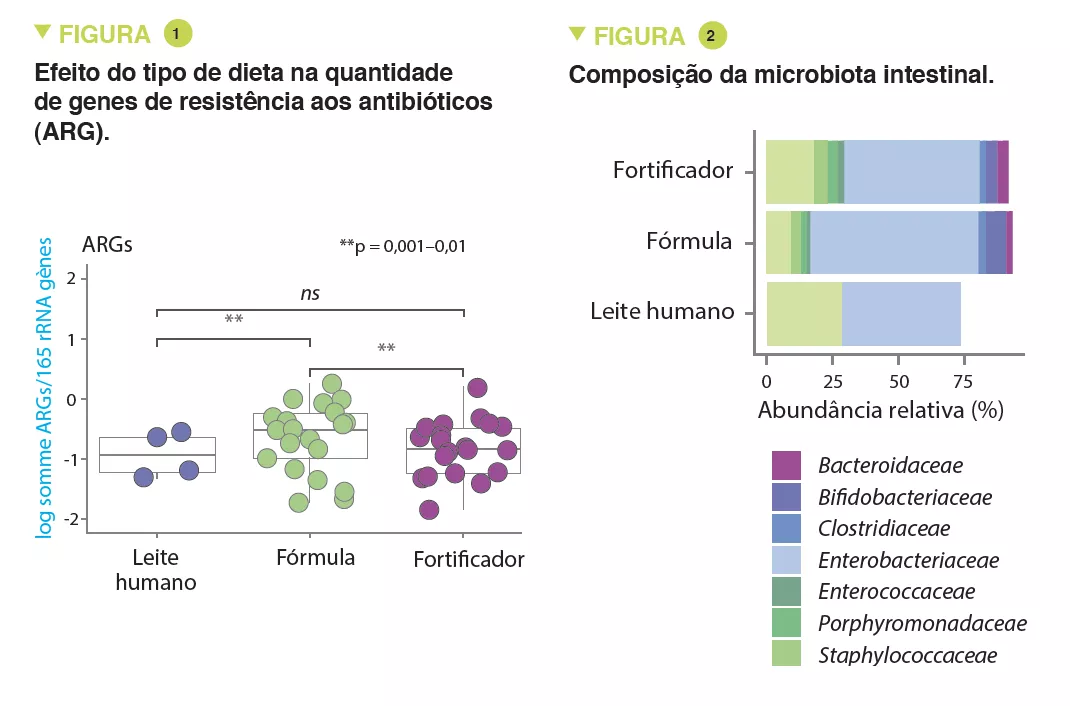
A MI tardia tinha uma diversidade beta e variabilidade intraindividual mais fracas do que a MI precoce (p < 0,001). A MI tardia era enriquecida em Bacteroides, Faecalibacterium, Lachnospira, Prevotella, Lachnospiraceae não classificados e Clostridiales não classificados, mas pobre em Clostridium, Veillonella, Bifidobacterium e Enterobacteriaceae não classificados. A análise dos componentes principais permitiu a identificação de 2 clusters (C1 e C2, Figura 1). O C1 era composto por 75,5% de amostras precoces e o C2 era composto por 63,7% de amostras tardias; as amostras precoces e tardias das crianças nascidas por via vaginal sem profilaxia antibiótica intraparto eram do tipo C2, dominadas pelo género Bacteroides (Figura 2).
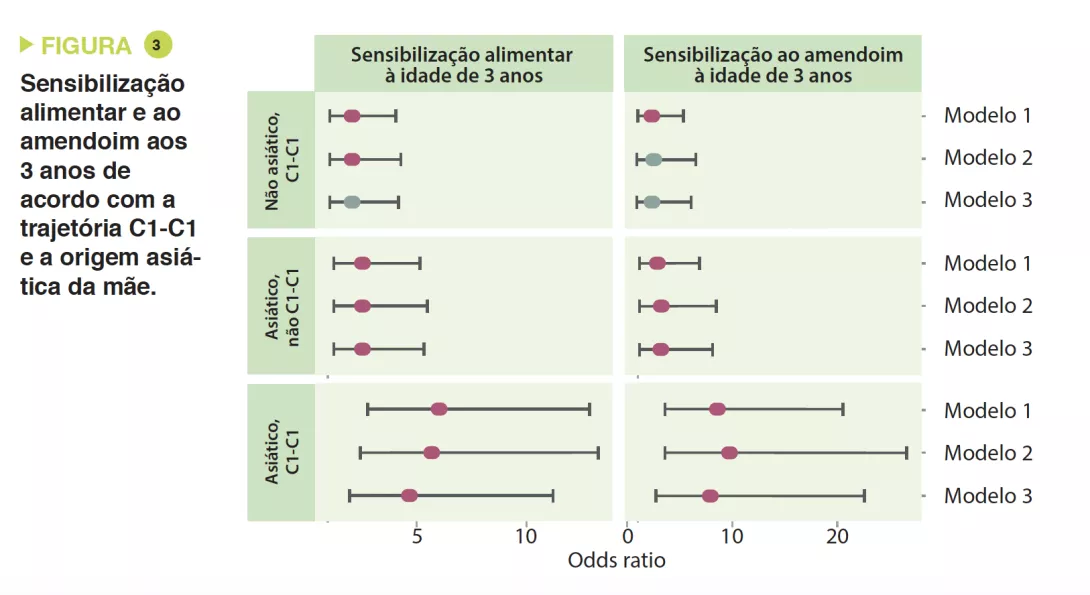
Os autores determinaram 4 trajetórias de acordo com o tipo de cluster precoce e tardio: C1-C1, C1-C2, C2-C1 e C2-C2. A trajetória C1-C1 é mais frequente nos lactentes asiáticos do que caucasianos (p < 0,05), bem como nas crianças com risco atópico vs. a trajetória C2-C2 (OR 1,9; IC 95% 1,15-3,14) ou C1-C2 (OR 2,38; IC 95% 1,43-3,96). Os lactentes da trajetória C1-C1 tinham o dobro da probabilidade de desenvolver sensibilização alimentar aos 3 anos de idade do que os da trajetória C2-C2 (OR 2,34; IC 95% 1,20-4,56) e C1-C2 (OR 2,60; IC 95% 1,33-5,09), nomeadamente ao amendoim (vs. C2-C2 = OR 2,82 ; IC 95% 1,13-6,01 e vs. C1-C2 = OR 2,01 ; IC 95% 0,85- 4,78) (Figura 3). As crianças que não adquiriram sensibilização ao amendoim aos 3 anos de idade tinham níveis persistentemente mais altos de Bacteroides (p = 0,044), níveis mais baixos de Enterobacteriaceae não classificados (p = 0,001) e uma relação E/B mais baixa (p = 0,013) durante a infância.
A trajetória C1-C1 da MI desempenhou o papel de mediador do risco de sensibilização alimentar e ao amendoim nas crianças de origem asiática. A associação foi mesmo forte para o amendoim (OR 7,87; IC 95% 2,75-22,55). Os lactentes da trajetória C1-C1 foram mais frequentemente colonizados por C. difficile; estas mesmas crianças, com a dupla característica de C1-C1 e colonizadas por C. difficile, tinham um risco superior de sensibilização alimentar (OR 5,69; IC 95% 1,62-19,99) e ao amendoim (OR 5,89; IC 95% 1,16-29,87).
Por último, a microbiota da trajetória C1-C1 tinha um défice no metabolismo dos esfingolípidos e nas funções relacionadas com a biossíntese dos glicoesfingolípidos.
Quais são as consequências práticas?
Este estudo permite considerar perspetivas terapêuticas dirigidas à MI na alergia alimentar dos lactentes, quer como medida preventiva ou terapêutica.