Regulação imunitária po diversidade de estirpes fúngicas na doença inflamatória intestinal
ARTIGO COMENTADO - FASE ADULTA
Pelo Prof. Pr Harry Sokol
Gastroenterologia e Nutrição, Hospital Saint-Antoine, Paris, França

Comentários sobre o artigo de Xin V. Li et al. Nature 2022 [1]
A microbiota fúngica (micobiota) é parte integrante da complexa comunidade microbiana que coloniza o trato gastrointestinal dos mamíferos e tem um papel importante na regulação imunitária. Embora as alterações na micobiota tenham sido associadas a várias doenças, incluindo a doença inflamatória intestinal (DII), desconhece-se atualmente se as espécies fúngicas identificadas por sequenciação representam organismos vivos e se fungos espec íficos têm efeitos sobre o desenvolvimento da DII. Os autores desenvolveram uma plataforma translacional para a análise funcional do micobioma. Combinando sequenciação micobiótica de alta resolução, culturomia fúngica e genómica, um sistema de edição de estirpes fúngicas baseado no CRISPR-Cas9, ensaios de imunorreatividade funcional in vitro e modelos in vivo, esta plataforma permite o exame do diafragma do hospedeiro-fungo no intestino humano. Descobrimos uma rica diversidade genética de estirpes oportunistas de Candida albicans que dominam a mucosa cólica de pacientes com DII. Entre estas estirpes isoladas, as estirpes com elevada capacidade de destruição das células imunitárias (estirpes HD) refletem as características da doença de pacientes com colit e ulcerosa e agravam a inflamação intestinal in vivo através de mecanismos dependentes da IL-1β. As respostas inflamatórias e antifúngicas das células T auxiliares produtoras de interleucina-17A (células Th17) induzidas pelas estirpes HD no intestino estavam dependentes da candialíssima, a toxina peptídea segregada pela C. albicans durante a transição de um estado comensal benigno para um estado patogénico. Estas descobertas revelam a natureza específica da estirpe das interacções hospedeiro-fúngicas no intestino humano e destacam novos alvos de diagnóstico e terapêuticos para a DII.
O QUE É QUE JÁ SABEMOS SOBRE ISTO?
Estudos baseados no sequenciamento profundo da micobiota intestinal em várias coortes de pacientes fornecem provas coerentes de que a “disbiose fúngica” é uma característica da doença inflamatória crónica intestinal (DII) [2], cujas formas mais disseminadas são a doença de Crohn (DC) e a colite ulcerativa (CU), que afetam milhões de indivíduos em todo o mundo. Os anticorpos anti-Saccharomyces cerevisiae (ASCA), dirigidos contra os mananos apresentados pela parede celular dos fungos, definem subtipos de DII, porque a sua presença no soro está associada à DC mas não à CU, o que estabelece uma ligação adicional entre os fungos e a DII. Candida é o género fúngico mais difundido, e a sua presença é sistematicamente aumentada em várias coortes de pacientes com DII analisados por sequenciação da microbiota fecal [2].
Em particular, a C. albicans no intestino induz um conjunto de anticorpos antifúngicos e atua como imunogéneo para ASCA. As espécies de Candida associadas à mucosa intestinal são detetadas pelos macrófagos presentes no intestino e demonstraram experimentalmente ter o potencial de induzir imunidade protetora ou de desencadear inflamação, dependendo do contexto [3]. Apesar desta evidência, desconhece-se atualmente se os fungos detetados por tecnologias de sequenciação no intestino humano têm um papel essencial na orientação da imunidade da mucosa ou na evolução da doença inflamatória em cada paciente individual. Tem-se observado repetidamente uma falta de correlação entre as alterações na composição da micobiota e a gravidade da doença nas coortes de pacientes com DII, apesar de um aumento constante das espécies de Candida. Os autores emitiram assim a hipótese de que a diversidade funcional das estirpes de Candida determina a relação hospedeiro-fungo na mucosa intestinal humana com um efeito na inflamação intestinal.
PONTOS CHAVE
- A micobiota é alterada em pacientes com DII e Candida albicans tem efeitos pró-inflamatórios
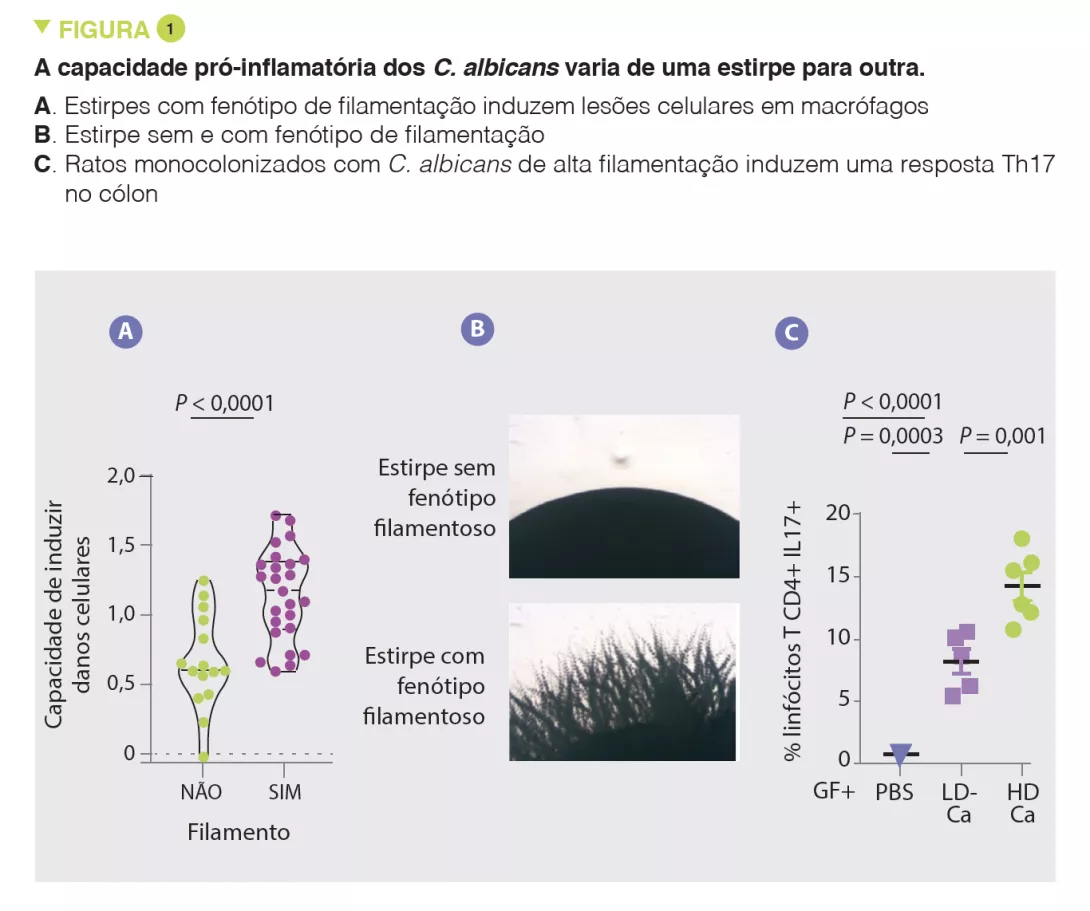
- Os efeitos pró-inflamatórios de C. albicans variam de uma estirpe para outra e estão associados à capacidade de induzir lesões celulares nos macrófagos e ao filamento
- Os efeitos pró-inflamatórios destas estirpes de C. albicans são mediados pela produção de candidalisina e pela indução da produção de IL-1β
- C. albicans, candidalisina e IL-1β são potenciais alvos terapêuticos na UC
QUAIS SÃO AS PRINCIPAIS CONCLUSÕES DESTE ESTUDO?
De acordo com numerosos outros estudos, os autores observaram pela primeira vez que as micobiota dos pacientes com UC eram ricas em Candida albicans e, em contraste, pobres em Saccharomyces. Na situação de resposta imunitária prejudicada induzida pela terapia com corticosteroides, a C. albicans exacerba a gravidade da colite em ratos. Os autores isolaram então várias estirpes de C. albicans da micobiota de sujeitos saudáveis e de pacientes com UC e observaram uma grande heterogeneidade em termos de capacidade pró-inflamatória. Em particular, a capacidade de causar danos celulares aos macrófagos, que são uma defesa fundamental contra os fungos, varia de uma estirpe para outra. As estirpes capazes de infligir danos celulares aos macrófagos têm uma maior tendência para o filamento e têm efeitos pró-inflamatórios in vivo, induzindo uma resposta Th17 (Figura 1).Os autores mostraram então que grande parte dos efeitos próinflamatórios foram mediados pela secreção de uma toxina, candialíssima, e pela indução da produção de IL-1β. As análises subsequentes revelaram uma forte correlação entre a capacidade pró-inflamatória de estirpes isoladas de pacientes com UC e a atividade inflamatória da doença. Por outro lado, não houve correlação entre a magnitude da inflamação intestinal e a abundância global de Candida albicans nos pacientes. Estes resultados explicam a fraca correlação entre a composição da micobiota e as características das patologias humanas e sugerem que as capacidades funcionais (pró-inflamatórias, neste caso) podem fornecer uma melhor explicação do papel da micobiota nestas patologias.
QUAIS SÃO AS CONSEQUÊNCIAS PRÁTICAS?
Este estudo mostra que, para além das análises da composição da micobiota, em particular através da sequenciação, é necessária uma análise funcional para compreender a sua contribuição para a doença e, em particular, no DII. Se se confirmar que as estirpes pró-inflamatórias de C. albicans, candidalisina e IL-1β têm um papel na UC, podemos imaginar uma opção terapêutica que visa um destes elementos, especialmente porque já estão disponíveis várias moléculas que antagonizam a via da IL-1β.
Conclusão
Este estudo sugere que a candialíssima é um fator chave no efeito pró-inflamatório de C. albicans no intestino e que algumas estirpes altamente pró-inflamatórias atuam através de mecanismos dependentes de IL-1β. Os pacientes portadores de estirpes altamente pró-inflamatórias podem representar uma população alvo para um tratamento antagonista da IL-1β e/ou da C. albicans.
1. Li XV, Leonardi I, Putzel GG, et al. Immune regulation by fungal strain diversity in inflammatory bowel disease. Nature 2022 ; 603 : 672-8.
2. Sokol H, Leducq V, Aschard H, et al. Fungal microbiota dysbiosis in IBD. Gut 2017 ; 66 : 1039-48.
3. Doron I, Leonardi I, Li XV, et al. Human gut mycobiota tune immunity via CARD9-dependent induction of anti-fungal IgG antibodies. Cell 2021 ; 184 : 1017-1031.e14.