La dermatitis atópica (DA) es una enfermedad inflamatoria de la piel compleja y multifactorial, con componentes genéticos (anomalías que afectan al gen que codifica la filagrina, que participa en la barrera cutánea), inmunitarios y también microbianos. Por ejemplo, la piel de los pacientes con DA suele presentar una mayor abundancia de Staphylococcus aureus. Pero ¿qué sucede con las comunidades fúngicas? Un estudio reciente1 acaba de dilucidar este misterio.
Menos Malassezia en caso de dermatitis atópica grave
Se tomaron muestran de piel a 16 pacientes con DA (9 casos de DA leve a moderada y 7 casos de DA grave) y 16 sujetos sanos, en cuatro zonas cutáneas (pliegue antecubital, parte dorsal del cuello, entrecejo y vértice). Para seguir la evolución por brotes de la enfermedad, las muestras se tomaron en tres ocasiones (semanas 0, 2 y 4) para los pacientes y en dos ocasiones para los controles (semanas 0 y 4).
El balance del análisis de las 320 muestras es que el hongo Malassezia (sobre todo las especies M. restricta y M. globosa) predomina en todos los participantes, sanos o enfermos. Pero en los pacientes con DA grave, este predominio desaparece en favor de hongos como Candida o Debaryomyces, lo cual se traduce por una mayor diversidad fúngica.
En lo referente a las bacterias, Cutibacterium es poco abundante, mientras que Staphylococcus, en especial S. aureus y S. epidermidis, están más presentes. La mayor presencia de S. aureus podría favorecer la proliferación de Candida, dada la conocida actividad sinérgica de los dos microorganismos.
Por último, durante las 4 semanas de observación, las microbiotas fúngica y bacteriana no evolucionaron, fuera cual fuera la localización cutánea.
Relación con la gravedad de la DA
El estudio muestra también una relación entre la disbiosis cutánea y el grado de DA: las comunidades bacterianas y fúngicas de los pacientes con DA grave diferían significativamente de las de los pacientes con formas leves a moderadas y de los controles. Por otra parte, las comunidades cutáneas de estos dos últimos grupos (formas leves a moderadas y controles) son globalmente similares, con algunas excepciones bacterianas (más estafilococos y menos cutibacterias en la DA leve a moderada respecto a los participantes sin DA). Por lo tanto, una disbiosis pronunciada de la microbiota es característica de las formas graves, pero no de las formas más leves de dermatitis.

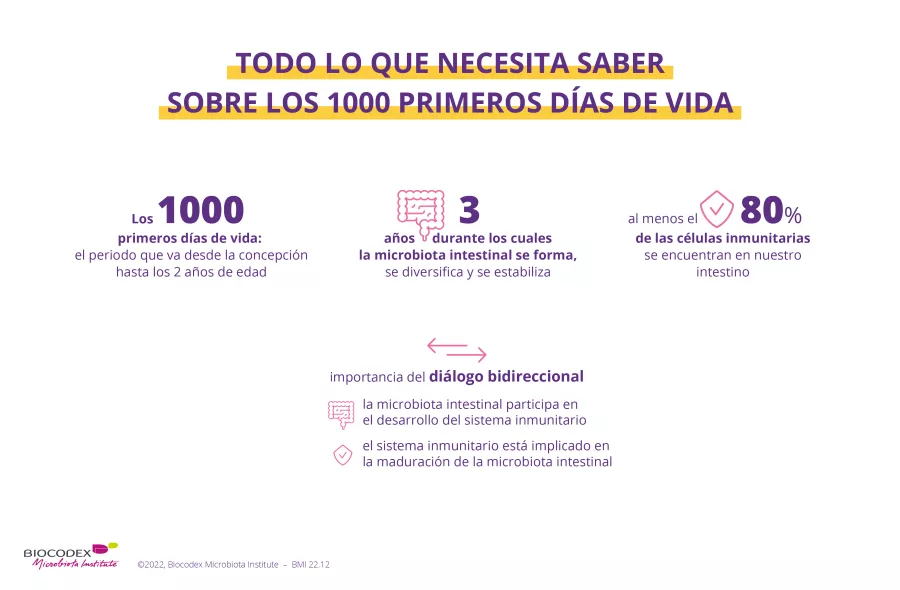
 Microbiota intestinal: aún mucho por descubrir
Microbiota intestinal: aún mucho por descubrir
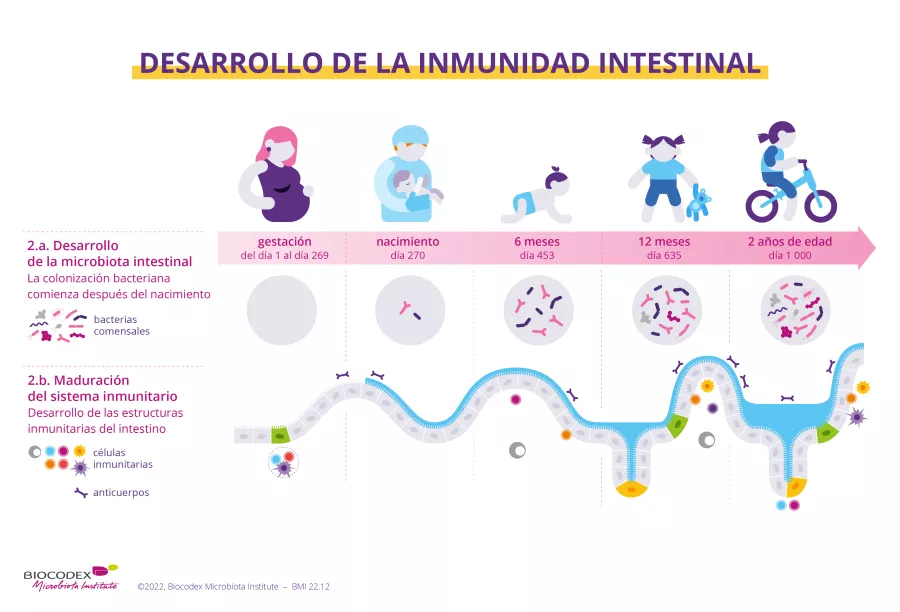
 Osteoporosis: la microbiota intestinal digiere mal la vitamina D
Osteoporosis: la microbiota intestinal digiere mal la vitamina D