El eje intestino-cerebro
Por el Prof. Sarkis K. Mazmanian, John W. Bostick, Nadia Suryawinata
Biología e Ingeniería Biológica, Instituto Tecnológico de California, Pasadena, CA, USA
Comentario sobre el artículo de Gabanyi et al. (Science 2022) [1]
La microbiota influye en el metabolismo, y datos recientes han relacionado las bacterias intestinales con comportamientos alimentarios de los ratones. Definir las vías intestino-cerebro que relacionan los compuestos microbianos con los procesos neuronales que afectan al apetito es un reto en este campo. En el estudio que nos ocupa, Gabanyi y sus colaboradores identificaron un papel funcional para Nod2, un receptor de reconocimiento de patrones para los muropéptidos bacterianos, unos componentes de la pared celular de las bacterias, en la regulación del apetito y la termorregulación en ratones hembra de edad avanzada. Los autores descubrieron que los muropéptidos se acumulan en el cerebro de ratones viejos y regulan la actividad de las neuronas inhibidoras del núcleo arqueado del hipotálamo. La insuficiencia provocada de Nod2 en estas neuronas provoca un mayor apetito, un aumento de peso y una reducción de la respuesta de la temperatura corporal que depende de la presencia de la microbiota. Estos resultados sugieren que la regulación de la actividad neuronal por la señalización de Nod2 en el cerebro influye en los comportamientos complejos de los ratones y justifica más investigaciones en el futuro.
¿QUÉ SE SABE YA SOBRE ESTE TEMA?
La ingesta de alimentos es fundamental para la supervivencia de los animales, y la regulación inadecuada del comportamiento alimentario desencadena graves consecuencias metabólicas y psiquiátricas, como la obesidad y la anorexia [2]. En la ingesta de alimentos intervienen procesos complejos que van desde el procesamiento y la absorción de nutrientes en el intestino y su periferia hasta el sistema nervioso central, que regula el apetito y dirige la alimentación. Gran parte de la atención en el campo de la biología del apetito se ha centrado en la caracterización de los circuitos neuronales implicados en la alimentación, como las neuronas que expresan el péptido relacionado con el agutí (AgRP) en el núcleo arqueado del hipotálamo y que son necesarias para la alimentación homeostática [3]. Más recientemente, se ha demostrado que el intestino y los microbios que residen en él regulan el metabolismo [4] y ciertos aspectos del comportamiento alimentario [5]. No se ha determinado si los compuestos producidos por los microbios influyen en el apetito. Los ácidos grasos de cadena corta, como subproducto de la fermentación microbiana, reducen la ingesta de alimentos en ratones [6].
Sin embargo, hasta el momento no se había demostrado una vía intestino-cerebro que relacionara los compuestos microbianos con los procesos neuronales que regulan el apetito y el comportamiento alimentario. Se ha sugerido que el receptor de reconocimiento de patrones microbianos Nod2 interviene en la alimentación, ya que los ratones con el gen Nod2 inactivado muestran un mayor aumento de peso cuando se les alimenta con una dieta con alto contenido de grasas [7]. Además, el componente de señalización de Nod2, el factor nuclear kB (NFkB) se expresa en las neuronas del hipotálamo, y su activación hipotalámica regula el equilibrio energético [8]. Esto sugiere que el hipotálamo puede presentar un punto de integración único para las señales derivadas del microbioma y los comportamientos alimentarios.
¿CUÁLES SON LOS PRINCIPALES RESULTADOS APORTADOS POR ESTE ESTUDIO?
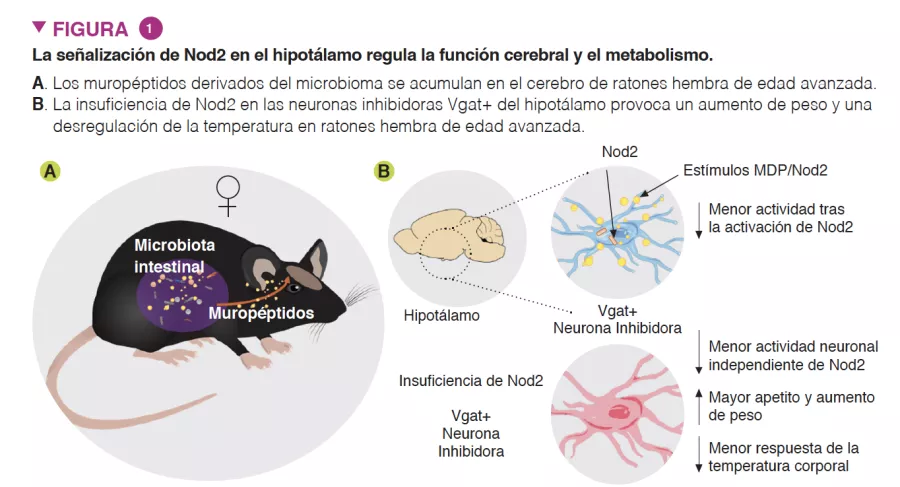
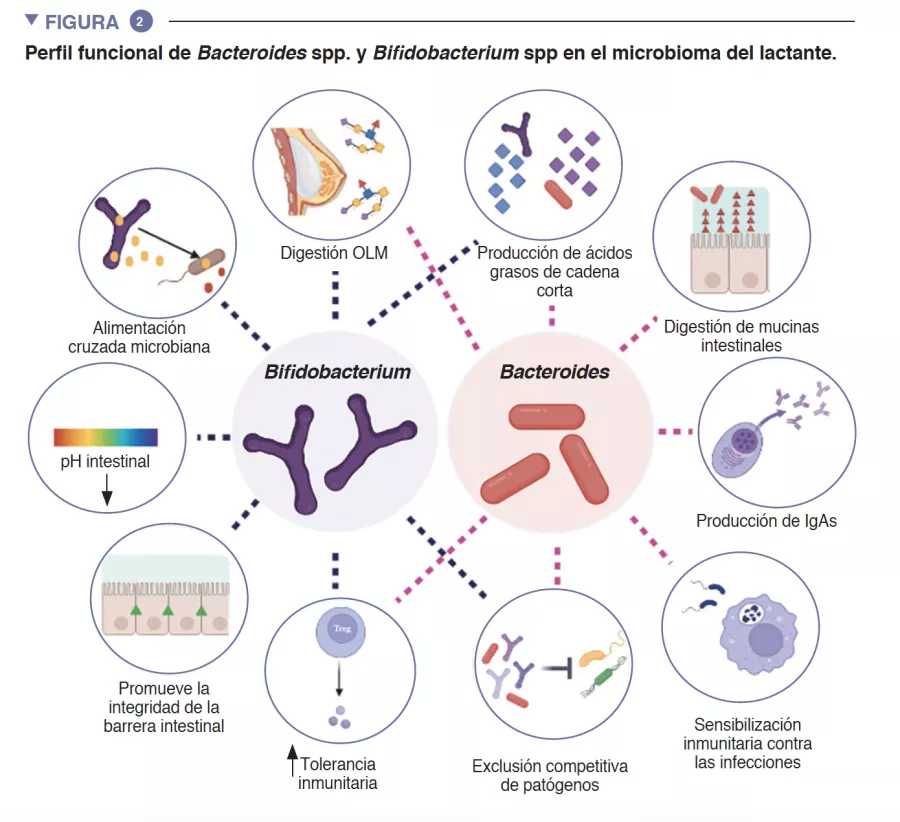
Los autores demostraron que la activación de la señalización de Nod2 en el hipotálamo afectaba al comportamiento alimentario y termorregulador de los ratones (Figura 1). Se descubrió que Nod2 se expresaba en las neuronas en múltiples regiones del cerebro de los ratones, como el cuerpo estriado, el tálamo y el hipotálamo. A continuación, los autores investigaron si los muropéptidos radiomarcados podían llegar al cerebro cuando se introducían por el tubo gastrointestinal directamente o a través de bacterias radiomarcadas. Ambos métodos de administración dieron lugar a la acumulación de muropéptidos en el cerebro.
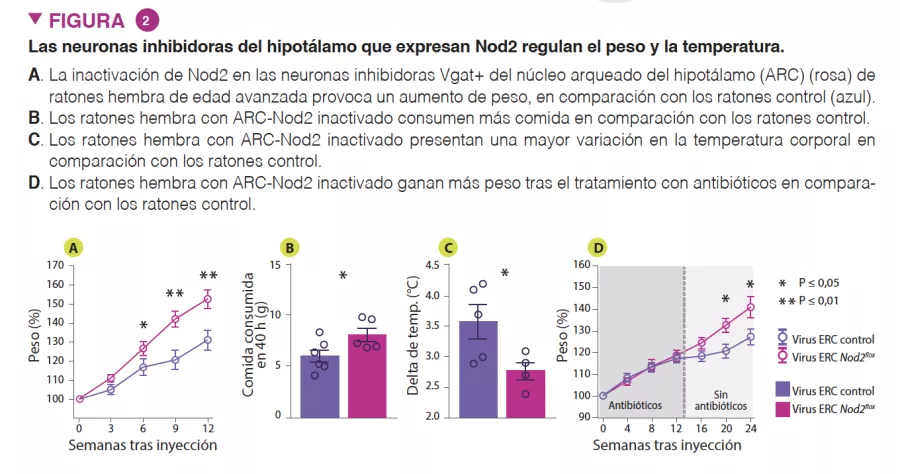
Para investigar el papel funcional de Nod2 en las neuronas, se utilizaron modelos de ratones con genes inactivados secundarios cuyo objetivo era la inhibición de Nod2 para demostrar que los ratones hembra de edad avanzada con Nod2 suprimido en las neuronas inhibidoras que expresan el transportador vesicular de GABA (Vgat/ Slc32a1) presentan un aumento de peso y un control desregulado de la temperatura. La medición de la expresión de Fos en el cerebro reveló que los ratones hembra de mayor edad presentan una mayor actividad neuronal en las regiones del núcleo arqueado y dorsomedial del hipotálamo. A continuación, los autores inyectaron virus adenoasociados (AAV) que expresan ECR en ratones Nod2flox para eliminar la expresión de Nod2 localmente en las neuronas inhibidoras del núcleo arqueado del hipotálamo, lo que ha demostrado que la insuficiencia de Nod2 en las neuronas hipotalámicas era suficiente para provocar cambios de peso y desregulación de la temperatura (Figura 2)
Por último, para examinar la función de la microbiota en los cambios relacionados con Nod2 en la regulación del apetito y de la temperatura, los autores trataron a ratones con Nod2 específico de las neuronas del hipotálamo inactivado con antibióticos de amplio espectro. En los ratones con insuficiencia de Nod2 en el hipotálamo que recibieron un tratamiento con antibióticos se observó un apetito y un aumento de peso normales hasta la retirada de los antibióticos, momento en el que presentaron un mayor apetito y un aumento de peso en comparación con los ratones testigo sin insuficiencia de Nod2. Estos datos sugieren que los productos derivados de la microbiota pueden modular el apetito en los ratones hembra mediante un mecanismo dependiente de Nod2.
PUNTOS CLAVE
- Nod2 se expresa en las neuronas en múltiples regiones del cerebro de los ratones, como el cuerpo estriado, el tálamo y el hipotálamo
- Los ligandos de Nod2, como los muropéptidos, se acumulan en el cerebro de los ratones más mayores
- La actividad de las neuronas inhibidoras del hipotálamo está regulada por la expresión de Nod2
- La regulación del apetito y la temperatura se altera en ratones hembra de edad avanzada con insuficiencia de Nod2
¿CUÁLES SON LAS CONSECUENCIAS EN LA PRÁCTICA?
En este interesante y novedoso trabajo, Gabanyi et al. han identificado un papel funcional para la expresión de Nod2 en las neuronas del hipotálamo para la regulación del apetito y de la temperatura en ratones hembra de edad avanzada, pero no en ratones macho. Aún hay que esclarecer los mecanismos celulares y moleculares que determinan este efecto. Las diferencias debidas al sexo en la composición del microbioma pueden desempeñar una función en las disimilitudes en la respuesta ante la insuficiencia neuronal de Nod2. Sin embargo, los autores no investigaron la composición microbiana. Por otra parte, además de los muropéptidos, existen otros productos derivados de los microbios y estímulos endógenos que pueden regular la expresión o la activación de Nod2 [9], aunque no se tratan en este estudio. Se necesitan más datos para distinguir la actividad y la contribución de estos estímulos alternativos de los muropéptidos. Otros posibles factores que contribuyen a los resultados que se recogen en el trabajo pueden ser el aumento de la permeabilidad del intestino y de la barrera hematoencefálica que se produce con la edad, que posiblemente permita que un mayor número de moléculas derivadas de los microbios entren en la circulación desde el intestino y se acumulen en el cerebro [10]. Se necesitan más investigaciones para aclarar la función que desempeña el sexo y la edad en los fenotipos observados.
Conclusión
Este estudio señala que la insuficiencia de Nod2 en las neuronas del hipotálamo basta para provocar cambios en la regulación del apetito y la temperatura en ratones hembra de edad avanzada. Para validar estos fascinantes hallazgos es necesario repetirlos en ratones y llevar a cabo trabajos en humanos.
1. Gabanyi I, Lepousez G, Wheeler R, et al. Bacterial sensing via neuronal Nod2 regulates appetite and body temperature. Science 2022; 376: eabj3986.
2. Gautron L, Elmquist JK, Williams KW. Neural control of energy balance: translating circuits to therapies. Cell 2015; 161: 133-45.
3. Chen Y, Lin YC, Kuo TW, Knight ZA. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell 2015; 160: 829-41.
4. Zarrinpar A, Chaix A, Xu ZZ, et al. Antibiotic-induced microbiome depletion alters metabolic homeostasis by affecting gut signaling and colonic metabolism. Nat Commun 2018; 9: 2872.
5. Yu KB, Hsiao EY. Roles for the gut microbiota in regulating neuronal feeding circuits. J Clin Invest 2021; 131: 143772.
6. Frost G, Sleeth ML, Sahuri-Arisoylu M, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun 2014; 5: 3611.
7. Rodriguez-Nunez I, Caluag T, Kirby K, Rudick CN, Dziarski R, Gupta D. Nod2 and Nod2-regulated microbiota protect BALB/c mice from diet-induced obesity and metabolic dysfunction. Sci Rep 2017; 7: 548.
8. Zhang X, Zhang G, Zhang H, Karin M, Bai H, Cai D. Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity. Cell 2008; 135: 61-73.
9. Kuss-Duerkop SK, Keestra-Gounder AM. NOD1 and NOD2 Activation by Diverse Stimuli: a Possible Role for Sensing Pathogen-Induced Endoplasmic Reticulum Stress. Infect Immun 2020; 88: e00898-19.
10. Mossad O, Batut B, Yilmaz B, et al. Gut microbiota drives age-related oxidative stress and mitochondrial damage in microglia via the metabolite N6-carboxymethyllysine. Nat Neurosci 2022; 25: 295-305.