Me llamo Jennifer, tengo 32 años y soy jefa de producto en el sector de la moda.
¿Puede describirnos el síndrome del intestino irritable?
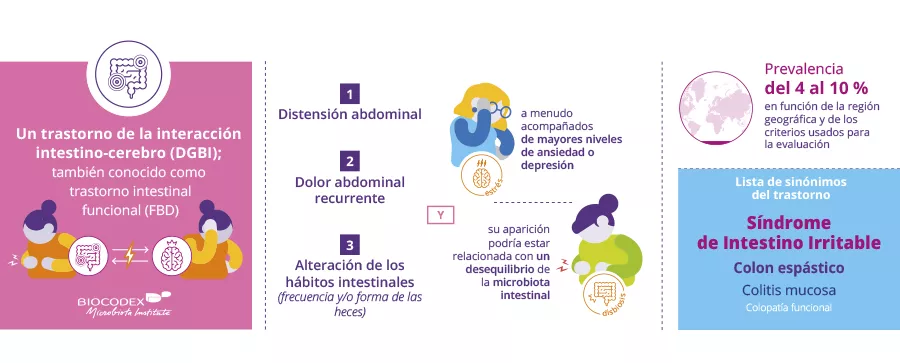
El síndrome del intestino irritable es una enfermedad digestiva crónica, invisible e incomprendida.
¿Cuáles eran sus síntomas?
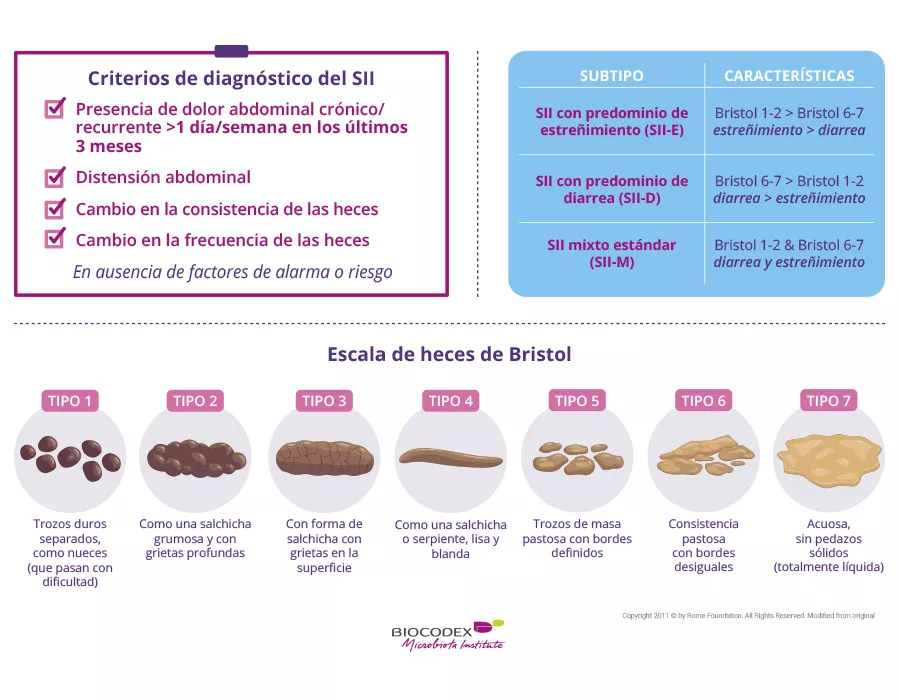
Tenía estreñimiento, como puñales en la barriga, dolor, espasmos, náuseas, diarrea de vez en cuando y además cansancio crónico.
Sorprendentemente, mis primeros síntomas fueron alergias alimentarias y también desarrollé un síndrome de Raynaud, es decir que las extremidades, las manos y los pies, se me ponían muy fríos, porque la sangre no circulaba.
Además, me dolía la espalda y eso me obligó a llevar una faja a los 25 años.
¿Cuánto tiempo tuvo que esperar antes del diagnóstico?
Tuve estos síntomas durante 21 años antes de que me diagnosticaran el SII a los 29 años.
¿Qué fue lo que la impulsó a consultar a un médico?
Una mañana, una vez más me levanté extremadamente cansada y con mucho retraso para ir al trabajo. En ese momento me desplomé.
¿Dónde buscó consejo sobre sus síntomas?
Al principio, consulté a médicos generales y gastroenterólogos, pero las respuestas siempre eran las mismas: como tenía más bien tendencia al estreñimiento, me daban muchos laxantes y no buscaban más lejos. También consulté a reumatólogos y nunca obtuve una respuesta hasta que el último gastroenterólogo que me vio me hablara del síndrome y de los FODMAP.
¿Qué son los FODMAP?
Son azúcares fermentables de los alimentos y pueden dar problemas a las personas que padecen el síndrome del intestino irritable.
¿Sabía que la microbiota intestinal podría estar implicada en el SII?
Supe que la microbiota estaba implicada cuando el gastroenterólogo me hizo comprender que mi alimentación era lo que me generaba problemas. A partir del momento en que cambié de alimentación, seguí el protocolo FODMAP y conseguí cuidar mi microbiota, todos los síntomas desaparecieron. Realmente todos.
¿Cómo es vivir día a día con el SII?
Día a día, manejo la enfermedad con una buena higiene de vida. Es muy necesario que duerma y tengo que prestar atención a lo que como. También intento evitar lo mejor que puedo cualquier fuente de estrés inútil que pueda actuar sobre la barriga y repercutir en la cabeza.
¿Qué puede decirnos de la relación intestino-cerebro en el SII?
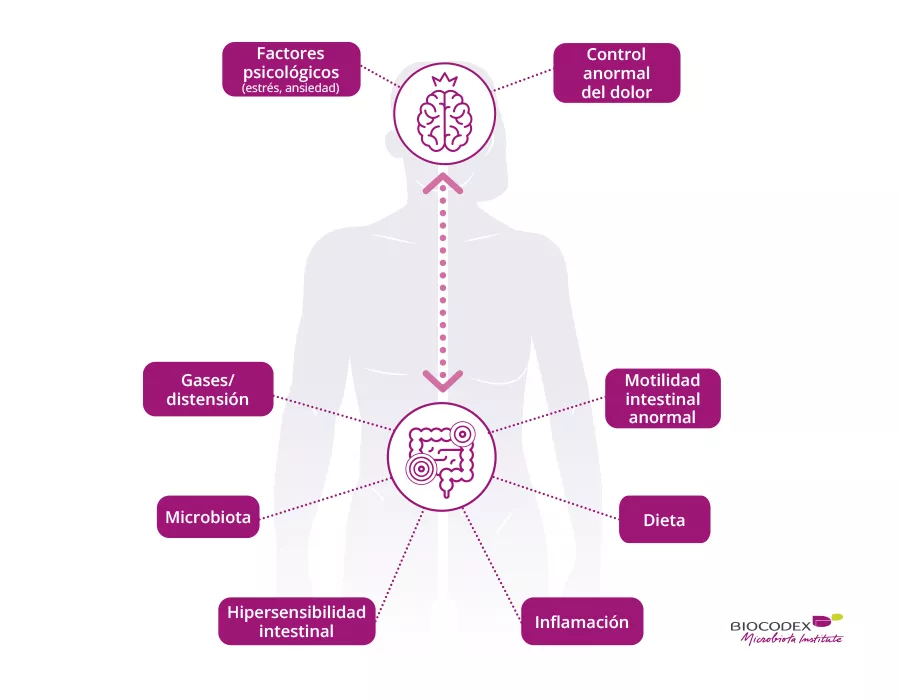
Para mí, el intestino irritable es la prueba de que existe una estrecha relación entre la cabeza y la barriga. Incluso creo que el intestino es el primer cerebro. Cuando las cosas van mal en la barriga, no pueden ir bien en la cabeza.
¿Qué mensaje daría a las personas con un SII?
Son muchos los consejos que podría dar a las personas que tienen un intestino irritable, por eso tengo un blog que se llama foodmapers.com, en el que reúno todos mis consejos.
Escuche su cuerpo, confíe en usted. El problema no está en su cabeza. Si siente que algo no marcha bien, quizá tenga algo que ver con la microbiota y su forma de digerir.
A mí me pasó. No es aceptable hacerse radiografías y ecografías sin descanso durante 20 años y seguir oyendo que no hay nada. Seguro que hay algo. Una vez que se llega al diagnóstico, hay muchas cosas que hacer en el aspecto nutricional, la ansiedad, el estrés y el sueño.
Unas últimas palabras
Conviene mantener la positividad, pero sobre todo continuar investigando, no rendirse y buscar a profesionales sanitarios que sean capaces de apoyarle y ayudarle a encontrar cuál es el problema.
 De la disbiosis intestinal a la infección urinaria
De la disbiosis intestinal a la infección urinaria
 Microbiota urogenital: el espectro de las micosis o infecciones del tracto urinario después de cada tratamiento con antibióticos
Microbiota urogenital: el espectro de las micosis o infecciones del tracto urinario después de cada tratamiento con antibióticos