¿QUÉ SE SABE YA SOBRE ESTE TEMA?
Los trastornos del desarrollo neurológico son frecuentes en los niños pequeños, y afectan hasta al 8,4 % de los menores de 5 años en el mundo. El crecimiento del perímetro cefálico (HCG) es un marcador que se correlaciona con un desarrollo neurológico precoz.
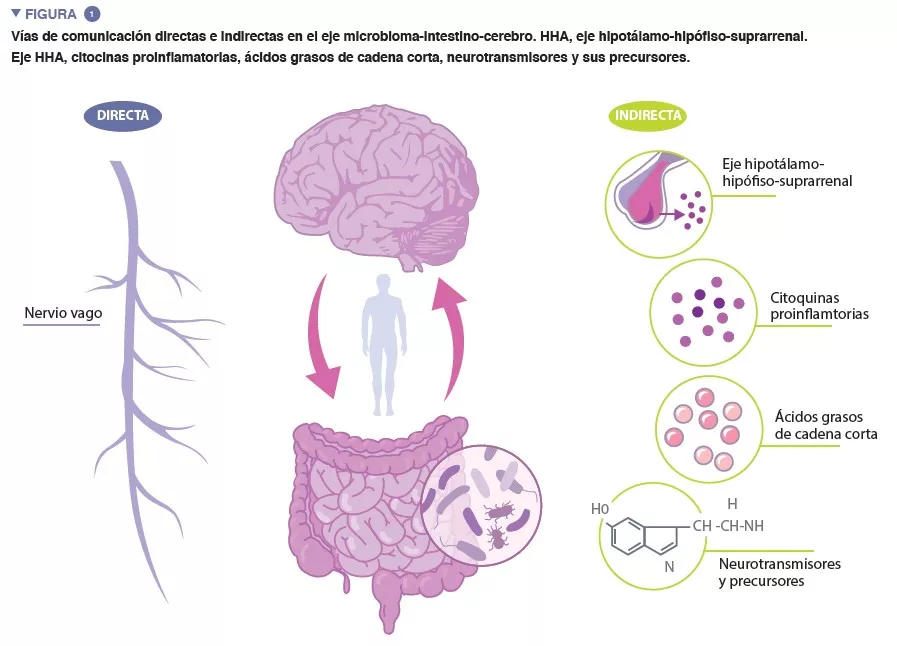
Es importante investigar los factores ambientales que se podrían modificar para reducir los trastornos del desarrollo neurológico. Los estudios de intervención sobre nutrición no han aportado resultados significativos sobre el neurodesarrollo (por ejemplo, el beneficio de la lactancia materna). Los autores se han interesado por la microbiota intestinal (MI) porque su establecimiento durante los primeros meses de vida, al igual que el consumo de antibióticos durante el primer año, se asocian a distintas patologías, como los trastornos del neurodesarrollo más adelante en la infancia, en concreto los trastornos por déficit de atención con hiperactividad y el trastorno del espectro autista.
El objetivo del estudio era investigar si las características de la MI precoz se asociaban a una trayectoria subóptima de HGT (SHCGT).
¿CUÁLES SON LOS PRINCIPALES RESULTADOS APORTADOS POR ESTE ESTUDIO?
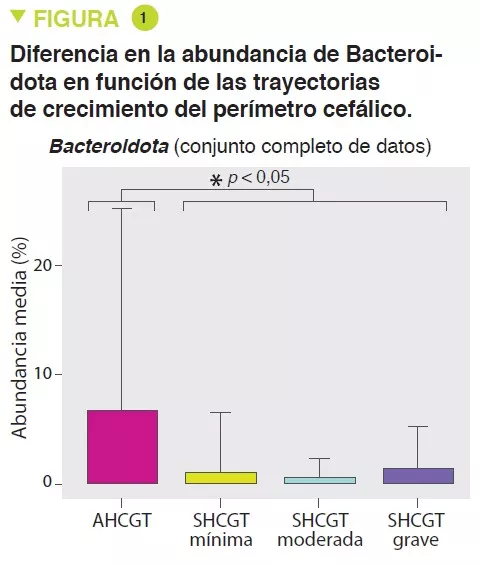
Se incluyeron neonatos nacidos con <37 semanas de edad gestacional (servicio de neonatología de Chicago) entre enero de 2010 y diciembre de 2018. La trayectoria de HCG era la diferencia en la puntuación estándar del perímetro cefálico medido a las 36 semanas de amenorrea (SA) y al nacimiento; los intervalos de 0,5 de la puntuación estándar definían los grupos con una trayectoria HCG apropiada (AHCGT) o alterada (SHCGT, mínima, moderada y grave).
La diversidad β de la MI era significativamente diferente entre los lactantes del grupo SHCGT y del AHCGT, al igual que el cambio en la abundancia de taxones en las heces en la semana 30 de amenorrea. En los grupos SHCGT, el descenso de >0,5 de la puntuación estándar de HCG se produjo entre las semanas 31 y 36 de amenorrea. Esto sugiere que una MI “inmadura” precede a la SHCGT
Los lactantes SHCGT presentaban una abundancia significativamente menor de Bacteroidota (p = 0,0009) (Figura 1) y Lachnospiraceae (p = 0,009), entre las semanas 31 y 36 de amenorrea, lo que podría acarrear una menor capacidad de utilización de los carbohidratos por parte de estos taxones. La prevalencia de familias de Ruminococcaceae (p = 0,007) se atribuía a la especie Faecalibacterium prausnitzii (p = 0,004), con un 48 % en el grupo AHCGT frente a un 8 % del grupo SHCGT. Se produjo un aumento de Firmicutes en el grupo SHCGT entre las semanas 24 a 30 de amenorrea (p = 0,009) pero no hubo diferencias en los subtaxones.
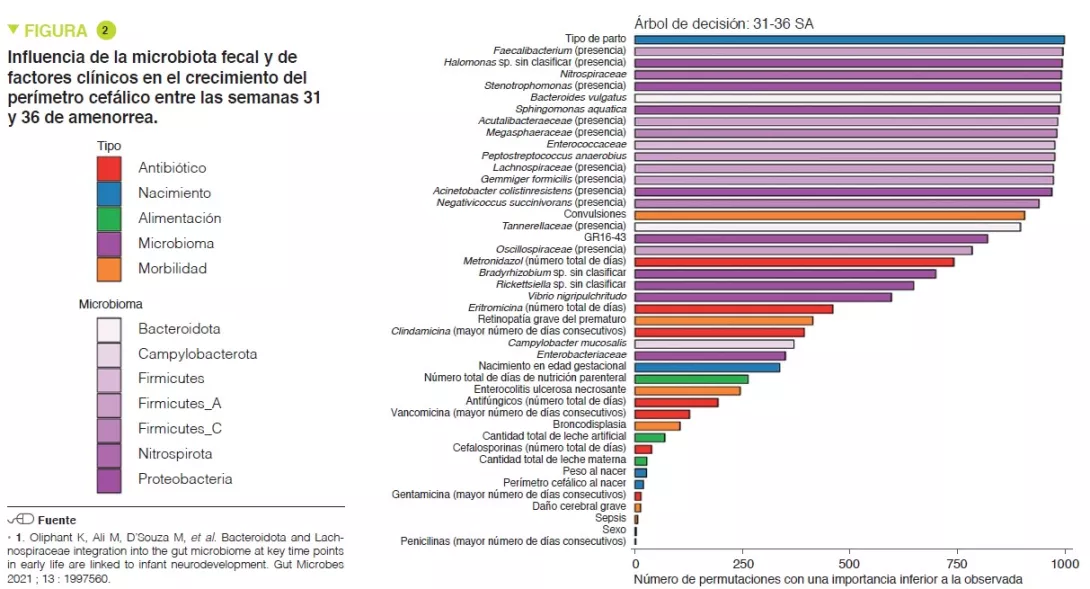
El análisis de los parámetros clínicos demostró que los cambios de HCG no se debían a la restricción calórica. Los niños de los grupos SHCGT presentaban más morbilidades que los del (p = 0,0006), lesiones neurológicas graves (p = 0,01), sepsis (p = 0,03). Sin embargo, los métodos de análisis estadístico utilizados, como los árboles de decisión, con permutaciones, han demostrado que los factores más importantes asociados a las trayectorias HCG correspondían más con las características de la MI y no tanto con las morbilidades asociadas, tanto en las semanas 24 a 30 como en las semanas 31 a 36 de amenorrea (Figura 2). En los lactantes sin morbilidades graves, las diferencias de Bacteroidota y Lachnospiraceae seguían estando presentes, pero la abundancia de Actinobacteriota era significativamente mayor en los grupos AHCGT y con SHCGT mínima que en los grupos con SHCGT moderada y grave.
El tipo de parto repercute más en las trayectorias de la HCG que los factores que influyen en la MI, como la nutrición enteral y los tratamientos con antibióticos. Esto se relaciona con la transmisión de la MI en el momento del parto, ya que la abundancia de Bacteroidota es mayor en lactantes que nacen por parto vaginal que en nacidos por cesárea. De hecho, entre los nacidos por parto vaginal, los que tenían una SHCGT presentaban una disminución de la abundancia de taxones anteriormente descritos como relacionados con las trayectorias de HCG, en comparación con AHCGT. Además, el tipo de parto es un factor importante, ya que todos los lactantes del grupo SHCGT nacidos por vía vaginal lo hicieron antes de las 27 semanas de edad gestacional, mientras que solo el 17 % de los del grupo AHCGT nacidos por vía vaginal lo hicieron antes de las 27 semanas de edad gestacional.
¿CUÁLES SON LAS CONSECUENCIAS EN LA PRÁCTICA?
Por todo ello, es posible que la SHCGT comience con una reducción de la abundancia de Bacteroidota y Lachnospiraceae, para después empeorar con la reducción de Actinobacteriota.
El nacimiento por parto vaginal permite una transmisión por vía vertical de Bacteroidota.
Sin embargo, hay que prestar atención a los neonatos nacidos antes de las 27 semanas de edad gestacional, porque parece que incluso los nacidos por parto vaginal presentan un mayor riesgo de SHCGT.
Es posible que estudios destinados a optimizar la MI desde los primeros días de vida en neonatos muy prematuros permitan confirmar y aclarar estos resultados.
 ¿Los fagos pueden resultar útiles en las infecciones multirresistentes?
¿Los fagos pueden resultar útiles en las infecciones multirresistentes?
 Hepatitis alcohólica: en busca de nuevas dianas terapéuticas relacionadas con la micobiota
Hepatitis alcohólica: en busca de nuevas dianas terapéuticas relacionadas con la micobiota