¿QUÉ SE SABE YA SOBRE ESTE TEMA?
Las bacterias resistentes a los antibióticos son la causa de numerosas muertes en el periodo neonatal. La aparición de bacterias resistentes se ve favorecida por el uso de antibióticos. Esto se asocia a una mayor abundancia de genes de resistencia a los antibióticos (ARG) que se encuentran en esas cepas bacterianas resistentes o multirresistentes. Estos ARG se transmiten entre las bacterias mediante elementos genéticos móviles (MGE). Además, se sabe que el tipo de alimentación modifica la microbiota intestinal, así como la cantidad de ARG. Lo que no se ha descrito suficientemente en las publicaciones es la magnitud del impacto de la alimentación en la resistencia.
¿CUÁLES SON LOS PRINCIPALES RESULTADOS APORTADOS POR ESTE ESTUDIO?
Los autores incluyeron a 46 niños prematuros nacidos entre las semanas 26 y 37 de embarazo; 21 recibieron una alimentación con leche artificial, 20 con leche materna enriquecida y 5 con leche materna. Se recogieron heces hasta el día 36 para analizar la composición de la microbiota intestinal y la presencia de ARG. Treinta lactantes recibieron un tratamiento con antibióticos: la recogida de heces se realizó aproximadamente dos semanas después de terminar el tratamiento para limitar los factores de confusión.
Para comparar los resultados con los datos extraídos de otras publicaciones, se analizó en paralelo un metaanálisis de 5 estudios que incluía a 696 neonatos con datos similares.
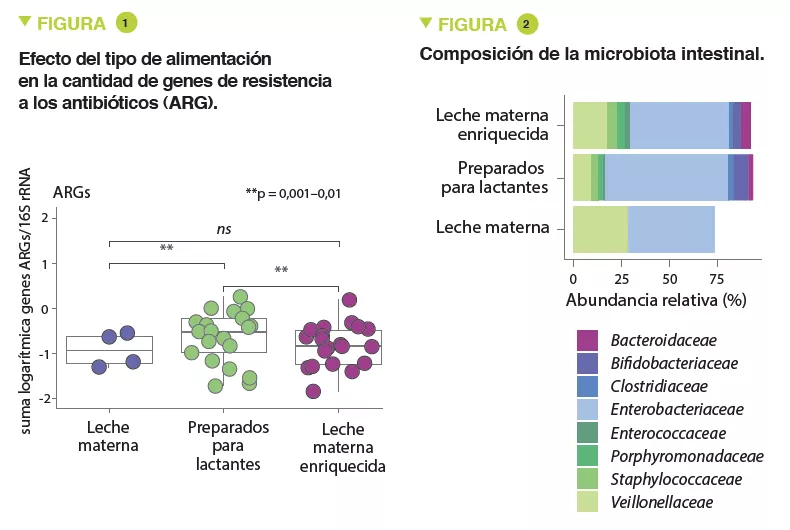
Los resultados indican que los recién nacidos que fueron alimentados con leche artificial presentaban una cantidad significativamente más alta de ARG que los recién nacidos que habían tomado leche materna enriquecida (x3,6; IC95% 1,61-8,9) o leche materna (x4,3; IC95% 1,61-11,56) (p<0,01) (Figura 1). La abundancia de MGE aumentaba en proporción similar (p<0,05). Las Enterobacteriaceae, de quienes se sabe que su genoma contiene más ARG móviles, eran más abundantes en los lactantes alimentados con leche preparada para lactantes (p<0,05) (Figura 2) y tendían a estar inversamente correlacionadas con la edad gestacional (p<0,1). La abundancia de ARG disminuía en los embarazos más largos (x0,72 ; IC95% 0,57-0,89) (p<0,001). Numerosos ARG eran más abundantes en los lactantes alimentados con leche artificial, incluidos los genes que codifican las betalactamasas de amplio espectro presentes en Klebsiella (p<0,05).
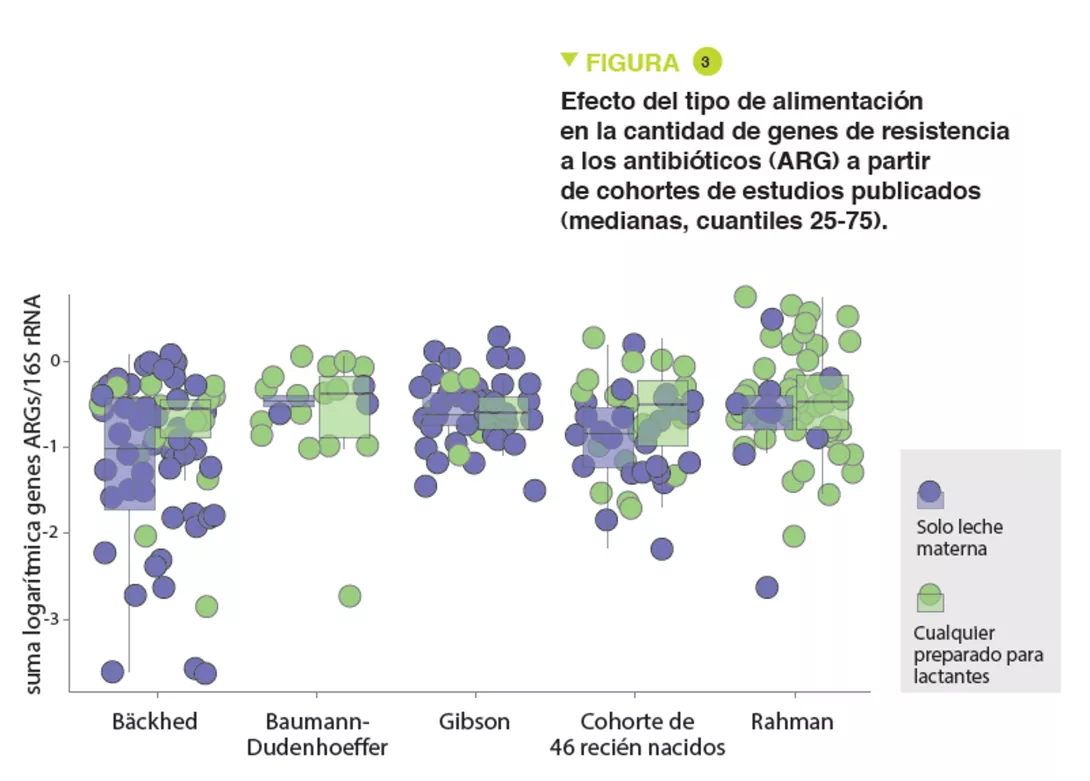
Se hallaron resultados similares en el metaanálisis: se observó un aumento relativo del 70% de los ARG en los recién nacidos alimentados con preparados para lactantes (p=0,013). La mediana de los ARG era más elevada en estos recién nacidos alimentados con preparados para lactantes en todas las cohortes (Figura 3). Por último, el análisis de la microbiota intestinal reveló que las bacterias pertenecientes a las familias Bifidobacteriaceae, Veillonellaceae, Clostridiaceae, Lachnospiraceae y Porphyromonadaceae (que incluyen bacterias anaerobias estrictas) disminuyeron en los neonatos alimentados con preparados para lactantes; y al contrario, aumentaron las bacterias anaerobias facultativas que pertenecen a Enterobacteriaceae, Staphyloccoccaceae y Enterococcaceae (p<0,05). Del mismo modo, varias especies potencialmente patógenas, que incluyen especies anaerobias facultativas como S. aureus, S. epidermidis, K. pneumoniae, K. oxytoca, y una especie anaerobia estricta Clostridioides difficile aumentaron en los neonatos alimentados con preparados para lactantes (p<0,001). El uso de preparados para lactantes favorece, pues, la proliferación de bacterias patógenas con ARG.
¿CUÁLES SON LAS CONSECUENCIAS EN LA PRÁCTICA?
Estos resultados respaldan los beneficios de la lactancia materna. La alimentación de los recién nacidos prematuros con leche artificial se asocia a un aumento del 70% de los ARG en comparación con los que han sido alimentados con leche materna exclusivamente. El enriquecimiento de la leche materna provoca un menor aumento de estos ARG.
 Antibióticos, microbiota del niño y salud a largo plazo
Antibióticos, microbiota del niño y salud a largo plazo
 Resistencia a antibioticos: la microbiota en primer plano
Resistencia a antibioticos: la microbiota en primer plano